
【题目】下列反应中,不属于离子反应的是( )
A.H2和O2的反应
B.铁与CuSO4溶液的反应
C.Ba(OH)2溶液和H2SO4溶液的反应
D.Zn和稀H2SO4反应
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】为除去括号内的杂质,所选用的试剂或方法正确的是
A. Na2CO3溶液(NaHCO3),加适量的Ca(OH)2溶液,过滤
B.Mg (Al),加过量的NaOH溶液,过滤
C.FeCl3溶液(CuCl2),加入过量的Fe粉,过滤
D.NaHCO3溶液(Na2CO3),加适量的CaCl2溶液,过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:稀溶液中,H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3kJmol﹣1 , 则浓硫酸与稀氢氧化钠溶液反应生成1mol水,放出的热量57.3kJ.(填>,<或=)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有0.1 mol·L-1Na2SO4溶液300mL,0.1 mol·L-1MgSO4溶液200mL和0.1 mol·L-1Al2(SO4)3溶液100mL,这三种溶液中硫酸根离子浓度之比是
A. 1︰1︰1 B. 3︰2︰1 C. 1︰1︰3 D. 3︰2︰3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)原子核外有3个电子层,其价电子数为7的元素其最高价氧化物对应水化物化学式________,其单质与NaOH反应的化学方程式为____________________________________________________。
(2)已知X+、Y2+、Zˉ、W2ˉ四种离子均具有相同的电子层结构,则X、Y、Z、W这四种元素的原子序数由大到小的顺序是___________________,原子半径由大到小的顺序是__________________。
(3) A+、Bˉ、C、D 四种粒子(分子或离子),它们都分别含10个电子,已知它们有如下转化关系:A++Bˉ![]() C+D↑,则A+、Bˉ的电子式:_____________ ,______________;比较C和D的稳定性的强弱:_____________________(用化学式表示)。
C+D↑,则A+、Bˉ的电子式:_____________ ,______________;比较C和D的稳定性的强弱:_____________________(用化学式表示)。
(4)①NH4NO3 ②NaF ③CO2 ④K2O2 ⑤NaOH ⑥CH4
以上只含有极性键的是_______(填序号),既有离子键又有非极性键的是______(填序号);既有离子键又有极性键的是______(填序号)。
(5)下列原子:![]() 中共有____种元素,__种核素。
中共有____种元素,__种核素。
(6)写出下列物质或微粒的电子式:
①CO2__________②KCl_____________③H2O2_______________④N2_____________;
⑤用电子式表示MgCl2的形成过程_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下图实验装置验证通过改变浓度来实现反应,2Fe3++2I-=2Fe2++I2中Fe3+与Fe2+的相互转化。K 闭合时,电流表指针第一次发生偏转,当指针归零后,向左管滴油加0.01mol/L的AgNO3溶液,发现指针第二次偏转,方向相反。下列有关说法不正确的是( )
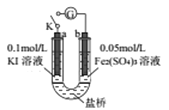
A. 指针第一次偏转时,b极反应式为Fe3++e-=Fe2+
B. 加入AgNO3后,a为正极
C. 当b极有0.001molFe3+被还原时,则通过盐桥的电子数为0.001NA
D. 第二次指针偏转的原因是:I-浓度减小,反应逆向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼是重要的化工原料。某探究小组利用下列反应制取水合肼(N2H4![]() H2O):
H2O):![]()
NaClO过量时,易发生反应:![]()
实验一:制备NaClO溶液(实验装置如图甲所示)

锥形瓶中发生反应的离子方程式是__________________。
实验二:制取水合肼(实验装置如图乙所示)

控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108-114℃馏分。
分液漏斗中的溶液是_____________(填序号);
A、CO(NH2)2溶液 B、NaOH溶液 C、NaOH和CO(NH2)2混合溶液 D、NaOH和NaClO混合溶液
选择的理由是_________________。
实验三:测定馏分中肼含量
称取馏分5.000g加入适量NaHCO3固体,加入配成250mL溶液,移出25.00mL,用0.1000mol/L的I2溶液滴定。滴定过程中,溶液的pH保持在6.5左右(已知:N2H4![]() H2O+2I2═N2↑+4HI+H2O)。
H2O+2I2═N2↑+4HI+H2O)。
配制250mL溶液所需仪器除分析天平、烧杯、玻璃棒外,还需______________。
滴定过程中,NaHCO3能控制溶液的pH在6.5左右,用离子方程式解释其原因:__________。
实验测得消耗I2溶液的平均值为20.00mL,馏分中水合肼(N2H4![]() H2O)的质量分数为____________。
H2O)的质量分数为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。单位质量的A和B的单质燃烧时均放出大量热,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
电离能/(kJ·mol-1) | I1 | I2 | I3 | I4 |
A | 932 | 1 821 | 15 390 | 21 771 |
B | 738 | 1 451 | 7 733 | 10 540 |
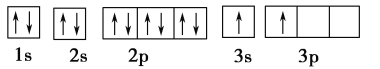
(1)某同学根据上述信息,推断B的核外电子排布如下图所示,该同学所画的电子排布图违背了________。
(2)ACl2分子中A原子的杂化类型为________。
(3)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。已知金刚石中的C—C键的键长大于C60中C—C键的键长,有同学据此认为C60的熔点高于金刚石,你认为是否正确________(填“是”或“否”),并阐述理由______________________________。
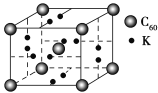
(4)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。写出基态钾原子的价电子排布式______________,该物质的K原子和C60分子的个数比为________。
(5)继C60后,科学家又合成了Si60、N60等,C、Si、N元素的电负性由大到小的顺序是______________________________,NCl3分子的VSEPR模型为________。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则一个Si60分子中π键的数目为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从南方往北方长途运输水果时,常常将浸泡有高锰酸钾溶液的硅藻土放置在盛放水果的容器中,其目的是( )
A.利用高锰酸钾溶液吸收水果产生的乙烯,防止水果早熟
B.利用高锰酸钾溶液吸收水果周围的氧气,防止水果腐烂
C.利用高锰酸钾溶液的氧化性,催熟水果
D.利用高锰酸钾溶液杀死水果周围的细菌,防止水果霉变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com