
【题目】某元素位于第三周期第ⅥA族。下列叙述不正确的是
A. 该元素是非金属元素 B. 该元素原子的核电荷数为16
C. 该元素原子核外有3个电子层 D. 该元素原子容易失去最外层电子
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
【题目】氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:
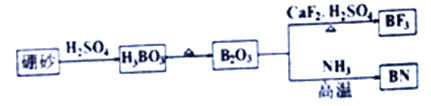
请回答下列问题:
(1)由B2O3制备BN的化学方程式是___________.
(2)基态B原子的电子排布式为___________;B和N相比,电负性较大的是_________,B元素的化合价为_________;
(3)在BF3分子中,F-B-F的键角是______,B原子的杂化轨道类型为________,BF3和过量NaF作用可生成NaBF4,BF4-的立体结构为_________;
(4)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为_________;
(5)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼的密度是_____________g/cm3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组做以下属于对SO2的性质进行研究。请回答下列问题:
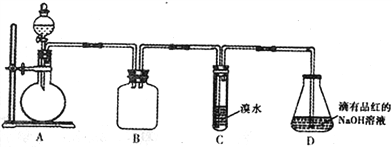
(1)装置B的作用是_______________________。
(2)装置C的目的是检验SO2的_____性。装置D中NaOH全部转化为NaHSO3的标志是_______________。
(3)请设计简单实验证明:室温下,NaHSO3溶液中HSO3-的电离平衡常数Ka与水解平衡常数Kb的相对大小关系_______________________________。
(4)向装置D所得NaHSO3溶液中加入NaClO溶液时,反应有下列三种可能的情况:
Ⅰ.HSO3-与ClO-恰好反应 Ⅱ. NaClO不足 Ⅲ. NaClO过量
甲同学分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请完成下表:(已知酸性:H2SO3>H2CO3>HClO)
实验序号 | 实验操作 | 现象 | 结论 |
① | 加入几小块CaCO3固体 | 有气泡产生 | Ⅰ或Ⅱ |
② | 滴加少量淀粉KI溶液,振荡 | __________ | Ⅲ |
③ | 滴加少量溴水,振荡 | _________ | Ⅱ |
④ | 滴加少量酸性KMnO4溶液,振荡 | 溶液呈紫色 | ______ |
(5)测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2 +2H2O==H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为_________g·L-1。
②在上述实验过程中,若有部分HI 被空气氧化,则测得结果________(填“偏高”、偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火柴头上通常含有氯酸钾、二氧化锰、硫等物质。某同学欲检验火柴燃烧后的气体中是否含有CO2,他应采用下列方法中的 ()
A.通入澄清的石灰水中B.先通入足量NaHCO3溶液中,再通入澄清石灰水中
C.通入品红溶液中D.先通入足量溴水中,再通入澄清石灰水中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格近中等优点。
①Cu的基态原子价电子排布式为_____________,
②Ni的基态原子共___________有种不同能级的电子。
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl+2CrO2Cl2+3COCl2↑
①上述化学方程式中非金属元素电负性由大到小的顺序是,________________,(用元素符号表示)
②COCl2分子中各原子均满足8电子稳定结构,COCl2分子中σ键和π键的个数比为_______________;中心原子的杂化方式为_____________。
③NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10-2nm和7.8×10-2nm。则熔点NiO__________FeO(填“>”、“<”或“=”),原因是_____________。
(4)Ni和La的合金是目前使用广泛的储氢材料。该合金的晶胞结构如右图所示:

①该晶体的化学式为_____________;
②已知该晶体的摩尔质量为Mg/mol,密度为dg/cm3,设NA为阿伏加德罗常数的值。则该晶胞的体积
是_____________ cm3(用M、d、NA的代数式表示)
③该晶体的内部具有空隙,且每个晶胞的空腺中储存6个氢原子比较稳定。已知:标准状况下氢气的密度为ρg/cm3。
储氢能力=![]()
若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为_______________。(用M、d、ρ的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. PCl3的空间构型为平面三角形
B. HF、HCl、HBr、HI的熔沸点依次升高
C. 乳酸(![]() )有一对手性异构体,因为其分子中含有一个手性碳原子
)有一对手性异构体,因为其分子中含有一个手性碳原子
D. 氯的各种含氧酸的酸性由强到弱排列为HClO>HClO2>HClO3>HClO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D的原子序数依次增大,B和C为同周期的金属元素,A和B的最外层电子数之和等于D元素原子的最外层电子数,A、B、C、D四种元素最高价氧化物对应的水化物分别为甲、乙、丙、丁,他们之间存在如图所示的反应关系(图中用“—“相连的两种物质间可发生反应),下列说法正确的是( )

A. 简单离子半径大小顺序:D>B>A>C
B. 等物质的量的BA3和B3A中含有的阴阳离子总数相等
C. 元素A和D的简单氢化物分子间仅存在范德华力
D. 元素B和D形成化合物的水溶液呈碱性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com