
【题目】[化学——选修3:物质结构与性质]
钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格近中等优点。
①Cu的基态原子价电子排布式为_____________,
②Ni的基态原子共___________有种不同能级的电子。
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl+2CrO2Cl2+3COCl2↑
①上述化学方程式中非金属元素电负性由大到小的顺序是,________________,(用元素符号表示)
②COCl2分子中各原子均满足8电子稳定结构,COCl2分子中σ键和π键的个数比为_______________;中心原子的杂化方式为_____________。
③NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10-2nm和7.8×10-2nm。则熔点NiO__________FeO(填“>”、“<”或“=”),原因是_____________。
(4)Ni和La的合金是目前使用广泛的储氢材料。该合金的晶胞结构如右图所示:

①该晶体的化学式为_____________;
②已知该晶体的摩尔质量为Mg/mol,密度为dg/cm3,设NA为阿伏加德罗常数的值。则该晶胞的体积
是_____________ cm3(用M、d、NA的代数式表示)
③该晶体的内部具有空隙,且每个晶胞的空腺中储存6个氢原子比较稳定。已知:标准状况下氢气的密度为ρg/cm3。
储氢能力=![]()
若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为_______________。(用M、d、ρ的代数式表示)
【答案】 3d104s1 7 O>Cl>C 3∶1 sp2 > 两者均为离子晶体,且阴阳离子电荷数均为2,但Fe2+的离子半径较大,离子晶体晶格能大,因此其熔点较低 LaNi5 ![]()
![]()
【解析】(1)①Cu是29号元素,位于元素周期表中第四周期第IB族,故Cu的基态原子价电子排布式为3d104s1.答案 3d104s1。
②Ni是28号元素,原子核外有1s、2s、3s、4s、2p、3p、3d等7个能级,
因此确答案是:7。
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl+2CrO2Cl2+3COCl2↑
①反应式中非金属元素有三种:O、C、Cl,CCl4中C表现正化合价、Cl表现负化合价,![]() 中Cl为+1价,O为-2价,电负性越大,对成键电子吸引力越大,元素相互化合时该元素表现负价,故电负性:
中Cl为+1价,O为-2价,电负性越大,对成键电子吸引力越大,元素相互化合时该元素表现负价,故电负性:![]() ,
,
因此,本题正确答案是:![]() ;
;
②![]() 分子中有1个
分子中有1个![]() 键和2个
键和2个![]() 键,所以
键,所以![]() 分子中
分子中![]() 键的数目为3,
键的数目为3,![]() 键的数目为1,个数比
键的数目为1,个数比![]() ,中心原子C电子对数
,中心原子C电子对数![]() ,故中心原子杂化方式为
,故中心原子杂化方式为![]() ,
,
③![]() 、
、![]() 的晶体结构类型均与氯化钠的相同,说明二者都是离子晶体,离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,熔点越高.因为
的晶体结构类型均与氯化钠的相同,说明二者都是离子晶体,离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,熔点越高.因为![]() 的离子半径小于
的离子半径小于![]() 的离子半径,属于熔点是
的离子半径,属于熔点是![]() ,
,
因此,本题正确答案是:![]() ; 两者均为离子晶体,且阴阳离子电荷数均为2,但Fe2+的离子半径较大,离子晶体晶格能大,因此其熔点较低。
; 两者均为离子晶体,且阴阳离子电荷数均为2,但Fe2+的离子半径较大,离子晶体晶格能大,因此其熔点较低。
(4)①该合金的晶胞如图所示,晶胞中心有一个镍原子,其他8个镍原子都在晶胞面上,镧原子都在晶胞顶点.
所以晶胞实际含有的镍原子为![]() ,晶胞实际含有的镧原子为
,晶胞实际含有的镧原子为![]() ,所以晶体的化学式
,所以晶体的化学式![]() ,因此,本题正确答案是:
,因此,本题正确答案是:![]() ;
;
②一个晶胞的质量 ,根据
,根据![]() ,即
,即 ,
,
因此,本题正确答案是: ;
;
③![]() 合金储氢后的密度
合金储氢后的密度 储氢能力
储氢能力 ,根据上述分析储氢材料的储氢能力为
,根据上述分析储氢材料的储氢能力为![]()


科目:高中化学 来源: 题型:
【题目】ⅣA、ⅤA、ⅥA、ⅦA 四个主族元素的氢化物的沸点变化趋势如下图所示,分析图中的递变规律,下列结论中正确的是( )

A. CH4 分子间的氢键较弱,故其沸点较低
B. 图中的横坐标的数值表示的是中心原子的主族序数
C. ⅣA 族元素氢化物的稳定性随相对分子质量的递增逐渐增强
D. H2O、HF、NH3 三种物质的沸点比同主族的其他氢化物都高,是因 为组成这三种物质的分子间均可形成氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素位于第三周期第ⅥA族。下列叙述不正确的是
A. 该元素是非金属元素 B. 该元素原子的核电荷数为16
C. 该元素原子核外有3个电子层 D. 该元素原子容易失去最外层电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Cl和Ba(OH)2反应是一个吸热反应,在反应过程中
A. 核能转化成热能
B. 化学能转化成热能
C. 生成物的总能量等于反应物的总能量
D. 生成物的总能量大于反应物的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中含有丰富的碘,为了从海带中提取碘,某研究性学习小组设计并进行以下实验:

请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是__________(从下列仪器中选出所需仪器,用标号字母填写在空白处);
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是_____________;
(3)写出步骤④的离子反应方程式(已知MnO2生成Mn2+和H2O )__________________ ;
(4)步骤⑤中,某学生选择用苯来提取碘的理由是______________________________ , 还可选用_____________________(写试剂的化学式)来提取碘,该步骤所用主要玻璃仪器的名称是__________________________。
(5)步骤⑥的目的是从含碘苯溶液中分离出单质碘,同时回收苯,该步骤的实验操作名称是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pKa=-lgKa,25℃时,H2A的pKa1=1.85,pKa2=7.19,用0.1molL-1NaOH溶液滴定20mL0.1molL-1H2A溶液的滴定曲线如图所示。下列说法不正确的是
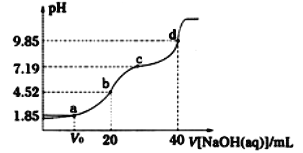
A. c点所得溶液中:c(A2-)=c(HA-)
B. b点所得溶液中:c(H2A)+c(H+)=c(HA-)+c(OH-)
C. A2-水解平街常数Kh(A2-)=10-7.19
D. a点所得溶液中,V0=10mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据等电子原理,由短周期元素组成的粒子,只要其电子总数相同,均可互称为等电子体。等电子体之间结构相似,物理性质也相近。以下各组粒子能互称为等电子体的是( )
A. O3和SO2 B. CO和N2 C. CO和NO D. N2H4 和C2H4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com