
【题目】根据等电子原理,由短周期元素组成的粒子,只要其电子总数相同,均可互称为等电子体。等电子体之间结构相似,物理性质也相近。以下各组粒子能互称为等电子体的是( )
A. O3和SO2 B. CO和N2 C. CO和NO D. N2H4 和C2H4
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格近中等优点。
①Cu的基态原子价电子排布式为_____________,
②Ni的基态原子共___________有种不同能级的电子。
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl+2CrO2Cl2+3COCl2↑
①上述化学方程式中非金属元素电负性由大到小的顺序是,________________,(用元素符号表示)
②COCl2分子中各原子均满足8电子稳定结构,COCl2分子中σ键和π键的个数比为_______________;中心原子的杂化方式为_____________。
③NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10-2nm和7.8×10-2nm。则熔点NiO__________FeO(填“>”、“<”或“=”),原因是_____________。
(4)Ni和La的合金是目前使用广泛的储氢材料。该合金的晶胞结构如右图所示:

①该晶体的化学式为_____________;
②已知该晶体的摩尔质量为Mg/mol,密度为dg/cm3,设NA为阿伏加德罗常数的值。则该晶胞的体积
是_____________ cm3(用M、d、NA的代数式表示)
③该晶体的内部具有空隙,且每个晶胞的空腺中储存6个氢原子比较稳定。已知:标准状况下氢气的密度为ρg/cm3。
储氢能力=![]()
若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为_______________。(用M、d、ρ的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼(Mo)是一种难熔稀有金属,我国的钼储量居世界第二。钼及其合金在冶金,农业、电器、化工、环保等方面有着广泛的应用。
(1)Mo可被发烟硝酸氧化,产物MoOF4和MoO2F2物质的量比为1:1,完成下列方程式:
____Mo+____HF+_____HNO3=_______MoO2F2+_______MoOF4+NO2↑+_____________,___________
(2)己知:
①2Mo(s)+3O2(g)=2MoO3(s) ΔH1
②MoS2(s)+2O2(g)==Mo(s)+2SO2(g) ΔH2
③2MoS2(s)+7O2(g)==2MoO3(s)+4SO2(g) ΔH3
则ΔH3=_______(用含ΔH1、ΔH2的代数式表示),在反应③中若有0.2molMoS2参加反应,则转移电子_____mol。
(3)密闭容器中用Na2CO3(s)作固硫剂,同时用一定量的氢气还原钼矿(MoS2)原理是:MoS2(s)+4H2(g)+2Na2CO3(s)==Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) ΔH
实验测得平衡时的有关变化曲线如图所示
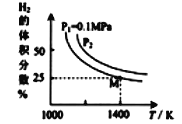
①由图可知,该反应的ΔH____0(填“>”或“<”)。
②如果上述反应在体积不变的密闭容器中达平衡,下列说法错误的是_____(选填编号)。
A.V正(H2)=V逆(H2O)
B再加入MoS2,则H2转化率增大
C.容器内气体的密度不变时,一定达平衡状态
D.容器内压强不变时,一定达平衡状态
③由图可知M点时氢气的平衡转化率为_____(计算结果保留0.1%)。
④平衡常数可用平衡分压代替平衡浓度计算,气体分压=气体总压×物质的量分数。求图中M点的平衡常数KP=_____(MPa)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D的原子序数依次增大,B和C为同周期的金属元素,A和B的最外层电子数之和等于D元素原子的最外层电子数,A、B、C、D四种元素最高价氧化物对应的水化物分别为甲、乙、丙、丁,他们之间存在如图所示的反应关系(图中用“—“相连的两种物质间可发生反应),下列说法正确的是( )

A. 简单离子半径大小顺序:D>B>A>C
B. 等物质的量的BA3和B3A中含有的阴阳离子总数相等
C. 元素A和D的简单氢化物分子间仅存在范德华力
D. 元素B和D形成化合物的水溶液呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用pH计测量VmL0.1mol·L-1NaOH溶液中逐滴滴加等浓度的一元酸HA后pH的变化情况,绘制pH变化曲线如图所示,下列说法不正确的是( )

A. A点溶液的pH=13
B. B和C两点所示溶液中水的电离程度:B>C
C. pH=7时,溶液中存在:c(Na+)=c(H+)+(HA)
D. C点所示溶液中离子浓度大小顺序:c(A-)>c(Na+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基甲酸铵是一种重要化工产品,常温时,为白色晶体或粉末,易溶于水,难溶于CCl4,59℃时分解为氨及二氧化碳,其制备原理:2NH3(g)+CO2(g)![]() NH2COONH4(s)△H=-272kJ·mol-1。某化学兴趣小组利用下图实验装置(部分固定装置已省略)模拟制备NH2COONH4。试回答下列问题:
NH2COONH4(s)△H=-272kJ·mol-1。某化学兴趣小组利用下图实验装置(部分固定装置已省略)模拟制备NH2COONH4。试回答下列问题:
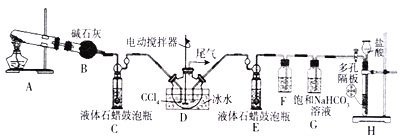
(1)仪器组装完毕后,首先应进行的操作是_____________________________。
(2)装置A用于实验室制取NH2COONH4的原料气体之一,该反应的化学方程式为_____________。
(3)装置F中试剂的名称为_________,装置G的作用为________________。
(4)为提高原料气的利用率,应控制装置C和E中最佳鼓泡速率比为____________,装置D采用冰水浴的原因为_____________________________________________________。
(5)生成的氨基甲酸铵悬浮于CCl4中,下列操作可实现产品分离的是_________。
![]()

(6)实验装置中存在明显不足之处的是______________,有同学认为装置H、G和F组成的装置过于复杂可简化,请简述该方法:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,能证明SiO2是酸性氧化物的是( )
A.SiO2+2C═Si+2CO↑
B.SiO2+2NaOH═Na2SiO3+H2O
C.SiO2+4HF═SiF4↑+2H2O
D.SiO2+CaCO3═CaSiO3+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C 分别代表中学化学中的常见物质,请根据题目要求回答下列问题:
(1)实验室常用A的饱和溶液制备微粒直径为1nm-100nm的红褐色液相分散系。则该反应的化学方程式为:_________________________,将A 的溶液加热蒸干并灼烧,得到固体的化学式为:________。
(2)B为地壳中含量最高的金属元素的氯化物,向50.0mL,4mol/L的B溶液中逐滴滴入100mL 某浓度的KOH溶液,若产生7.8g白色沉淀,则加入的KOH溶液的浓度可能为_________________________。
(3)将A、B中两种金属元素的单质用导线连接,插入同一个盛有KOH溶液的烧杯中构成原电池,则负极发生的电极反应为:_____________________________________。
(4)C是常见温室气体,将一定量的气体C通入100mL某浓度的KOH溶液得溶液F,向F溶液中逐滴加入2 mol·L-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。

则F 溶质与足量石灰水发生反应最多可得沉淀的质量为_______________g。
(5)pH=3.6时,碳酸钙与硫酸铝反应可制备碱式硫酸铝[Al2(SO4)x(OH)6-2x]溶液。若溶液的pH偏高,则碱式硫酸铝产率降低且有气体C产生,用化学方程式表示其原因: ______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钠是在1807年通过电解氢氧化钠制得的,这个原理应用于工业生产,约在1891年才获得成功。1921年实现了电解氯化钠制钠的工业方法,其反应原理是:2NaCl(熔融)![]() 2Na+Cl2↑。回答下列有关单质钠的问题:
2Na+Cl2↑。回答下列有关单质钠的问题:
(1)下列各项中属于保存金属钠的正确方法是____。
A.放在棕色瓶中 B.放在细沙中C.放在水中 D.放在煤油中
(2)将一小块钠放在水平放置的试管中部,用酒精灯加热充分反应(如图Ⅰ所示),请写出该反应的化学方程式____________,生成物的颜色为____。将该试管冷却后直立,滴加几滴水(如图Ⅱ所示),发生反应的化学方程式为____________,检验该反应产生的气体的方法是________________。

(3)Na、Na2O、Na2O2、NaOH久置空气中最终都是变为____________(填化学式);过氧化钠与CO2反应的化学方程式__________________________。因此,过氧化钠可作为呼吸面具和潜水艇的氧气来源。
(4)一小块金属钠投入CuCl2溶液中,发生反应的方程式为___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com