
【题目】钼(Mo)是一种难熔稀有金属,我国的钼储量居世界第二。钼及其合金在冶金,农业、电器、化工、环保等方面有着广泛的应用。
(1)Mo可被发烟硝酸氧化,产物MoOF4和MoO2F2物质的量比为1:1,完成下列方程式:
____Mo+____HF+_____HNO3=_______MoO2F2+_______MoOF4+NO2↑+_____________,___________
(2)己知:
①2Mo(s)+3O2(g)=2MoO3(s) ΔH1
②MoS2(s)+2O2(g)==Mo(s)+2SO2(g) ΔH2
③2MoS2(s)+7O2(g)==2MoO3(s)+4SO2(g) ΔH3
则ΔH3=_______(用含ΔH1、ΔH2的代数式表示),在反应③中若有0.2molMoS2参加反应,则转移电子_____mol。
(3)密闭容器中用Na2CO3(s)作固硫剂,同时用一定量的氢气还原钼矿(MoS2)原理是:MoS2(s)+4H2(g)+2Na2CO3(s)==Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) ΔH
实验测得平衡时的有关变化曲线如图所示
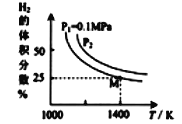
①由图可知,该反应的ΔH____0(填“>”或“<”)。
②如果上述反应在体积不变的密闭容器中达平衡,下列说法错误的是_____(选填编号)。
A.V正(H2)=V逆(H2O)
B再加入MoS2,则H2转化率增大
C.容器内气体的密度不变时,一定达平衡状态
D.容器内压强不变时,一定达平衡状态
③由图可知M点时氢气的平衡转化率为_____(计算结果保留0.1%)。
④平衡常数可用平衡分压代替平衡浓度计算,气体分压=气体总压×物质的量分数。求图中M点的平衡常数KP=_____(MPa)2
【答案】 2 6 12 1 1 12 9H2O △H1 +2△H2 2.8 >(1分) > B 66.7% 0.01
【解析】试题分析:(1)Mo元素化合价由0升高为+6,氮元素化合价由+5降低为+4,根据元素守恒,有水生成,根据电子守恒配平方程式;(2)根据盖斯定律计算ΔH3;2MoS2(s)+7O2(g)==2MoO3(s)+4SO2(g)反应中Mo、S化合价都升高,只有氧元素化合价降低;(3)①由图可知,升高温度氢气的体积分数降低,说明平衡正向移动;②A、达到平衡时,正逆反应速率相等;BMoS2是固体,再加入MoS2,平衡不移动; C.正反应气体质量增大,所以反应过程中气体密度增大;D.正反应气体物质的量增大,容器内压强是变量;③利用“三段式”计算M点时氢气的平衡转化率;④根据M点的平衡常数K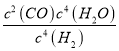 计算M点的平衡常数KP
计算M点的平衡常数KP
解析:(1)根据元素守恒,有水生成,根据都是电子守恒、元素守恒配平方程式为2Mo+6HF+12HNO3=MoO2F2+MoOF4+12NO2↑+9H2O;(2)①2Mo(s)+3O2(g)=2MoO3(s) ΔH1;②MoS2(s)+2O2(g)==Mo(s)+2SO2(g) ΔH2 ;根据盖斯定律②![]() ①得2MoS2(s)+7O2(g)==2MoO3(s)+4SO2(g) ΔH3=△H1 +2△H2;2MoS2(s)+7O2(g)==2MoO3(s)+4SO2(g)反应中Mo、S化合价都升高,只有氧元素化合价降低,2mol MoS2消耗7mol O2,转移28mol电子,所以0.2molMoS2参加反应,则转移电子2.8mol。(3)①由图可知,升高温度氢气的体积分数降低,说明平衡正向移动,正反应吸热,ΔH>0;②A、达到平衡时,正逆反应速率相等,所以达到平衡时V正(H2)=V逆(H2O),故A正确;B、MoS2是固体,再加入MoS2,平衡不移动,H2转化率不变,故B错误; C.正反应气体质量增大,所以反应过程中气体密度增大,密度不变时,一定达平衡状态,故C正确;D.正反应气体物质的量增大,容器内压强是变量,所以容器内压强不变时,一定达平衡状态,故D正确;
①得2MoS2(s)+7O2(g)==2MoO3(s)+4SO2(g) ΔH3=△H1 +2△H2;2MoS2(s)+7O2(g)==2MoO3(s)+4SO2(g)反应中Mo、S化合价都升高,只有氧元素化合价降低,2mol MoS2消耗7mol O2,转移28mol电子,所以0.2molMoS2参加反应,则转移电子2.8mol。(3)①由图可知,升高温度氢气的体积分数降低,说明平衡正向移动,正反应吸热,ΔH>0;②A、达到平衡时,正逆反应速率相等,所以达到平衡时V正(H2)=V逆(H2O),故A正确;B、MoS2是固体,再加入MoS2,平衡不移动,H2转化率不变,故B错误; C.正反应气体质量增大,所以反应过程中气体密度增大,密度不变时,一定达平衡状态,故C正确;D.正反应气体物质的量增大,容器内压强是变量,所以容器内压强不变时,一定达平衡状态,故D正确;
③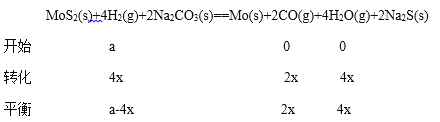
![]() ,a=6x,M点时氢气的平衡转化率
,a=6x,M点时氢气的平衡转化率![]() 66.7%;④根据方程式H2、CO、H2O=2x:2x:4x,氢气体积分数是25%,所以CO、H2O的体积分数分别是25%、50%,则KP=
66.7%;④根据方程式H2、CO、H2O=2x:2x:4x,氢气体积分数是25%,所以CO、H2O的体积分数分别是25%、50%,则KP=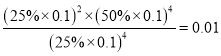 (MPa)2
(MPa)2


科目:高中化学 来源: 题型:
【题目】ⅣA、ⅤA、ⅥA、ⅦA 四个主族元素的氢化物的沸点变化趋势如下图所示,分析图中的递变规律,下列结论中正确的是( )

A. CH4 分子间的氢键较弱,故其沸点较低
B. 图中的横坐标的数值表示的是中心原子的主族序数
C. ⅣA 族元素氢化物的稳定性随相对分子质量的递增逐渐增强
D. H2O、HF、NH3 三种物质的沸点比同主族的其他氢化物都高,是因 为组成这三种物质的分子间均可形成氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中含有丰富的碘,为了从海带中提取碘,某研究性学习小组设计并进行以下实验:

请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是__________(从下列仪器中选出所需仪器,用标号字母填写在空白处);
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是_____________;
(3)写出步骤④的离子反应方程式(已知MnO2生成Mn2+和H2O )__________________ ;
(4)步骤⑤中,某学生选择用苯来提取碘的理由是______________________________ , 还可选用_____________________(写试剂的化学式)来提取碘,该步骤所用主要玻璃仪器的名称是__________________________。
(5)步骤⑥的目的是从含碘苯溶液中分离出单质碘,同时回收苯,该步骤的实验操作名称是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pKa=-lgKa,25℃时,H2A的pKa1=1.85,pKa2=7.19,用0.1molL-1NaOH溶液滴定20mL0.1molL-1H2A溶液的滴定曲线如图所示。下列说法不正确的是
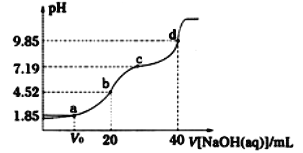
A. c点所得溶液中:c(A2-)=c(HA-)
B. b点所得溶液中:c(H2A)+c(H+)=c(HA-)+c(OH-)
C. A2-水解平街常数Kh(A2-)=10-7.19
D. a点所得溶液中,V0=10mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家模拟足贝类足丝蛋白的功能,合成了一种对云母、玻璃、二氧化硅等材料具有良好粘附性的物质一化合物I,其合成路线如下:
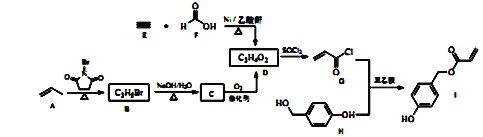
回答下列问题:
(1)A的化学名称为_____________________。
(2)由B生成C的化学方程式为_____________________________。
(3)由E和F反应生成D的反应类型为__________,由G和H反应生成I的反应类型为___________。
(4)D的结构筒式为____________,仅以D为单体合成高分子化合物的化学方程式为___________________。
(5)X是I的同分异构体,能发生银镜反应,能与饱和碳酸氢钠溶液反应放出CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6:2:1:1。写出两种符合要求的X的结构简式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯气体有毒,常应用在果蔬保鲜方面,用NaClO3与CH3OH (沸点64.7℃) 在催化剂、61℃时发生反应得到ClO2,实验装置如下图,(已知ClO2 的稳定性较差,用稳定剂吸收ClO2。使用时加酸释放出ClO2)。完成下列填空:
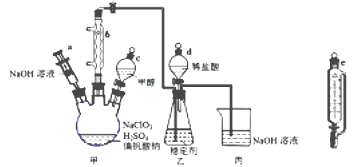
(1)仪器b的名称为________,其作用是_____________。
(2)反应中甲醇被氧化为甲酸(HCOOH),写出制备ClO2的化学方程式____________________。
(3)甲装置中采取的加热方式是________________,如果滴加甲醇的速度过快,可造成的后果____________。
(4)某同学建议将上述装置中的分液漏斗c改为恒压漏斗,你认为他的理由是______________________。
(5)实验结束后,先用仪器a 注入一定量的NaOH溶液,过一段时后再拆卸仪器,其目的是____________。
(6)下表是两种稳定剂加酸后释放ClO2的浓度随时间的变化数据,若将其用于樱桃保鲜,你认为效果较好的稳定剂是_______( 填"1”或“2”),原因是________________________________。
时间/天 稳定剂 | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 |
稳定剂1 | 80 | 150 | 80 | 20 | 10 | 5 | 0 | 0 | 0 |
稳定剂2 | 40 | 52 | 52 | 52 | 52 | 50 | 48 | 47 | 20 |
(7)某同学在实验室测定某保鲜剂中ClO2含量,其实验操作如下,在维形瓶中加入足量的KI溶液。再加入5mL稀硫酸,取15ml保鲜剂于锥形瓶中。ClO2与KI反应的离子方程式为:2ClO2+10I-+8H+==2C1-+5I2+4H2O;用0.1000 mol/L Na2S2O3标准溶液滴定碘单质(I2+2S2O32-=2I-+S4O62-) 。达到滴定终点时用去18.00mlNa2S2O3标准溶液,测得该保鲜剂中ClO2的含量为________g·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据等电子原理,由短周期元素组成的粒子,只要其电子总数相同,均可互称为等电子体。等电子体之间结构相似,物理性质也相近。以下各组粒子能互称为等电子体的是( )
A. O3和SO2 B. CO和N2 C. CO和NO D. N2H4 和C2H4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有如下各种说法,正确的是
①在水中氢、氧原子间均以化学键相结合
②分子中键能越大,键长越长,则分子越稳定
③干冰受热变为气体和碘升华所克服的粒子间作用力属于同种类型
④H2S和CS2分子都是含有极性键的极性分子
⑤气态双原子分子中肯定存在着![]() 键,可能存在着π键
键,可能存在着π键
⑥CH4、NH3、CCl4分子的空间构型是正四面体形
A.②③⑤ B.②⑥ C.③⑤ D.①④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com