
【题目】实验室用如下装置制取氯气,并用氯气进行实验。回答下列问题:
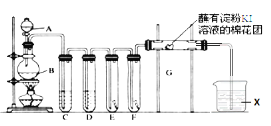
(1)A中盛有浓盐酸,B中盛有MnO2,写出反应的离子方程式__________________________。
(2)E中为红色干布条,F中为红色湿布条,可观察到的现象是________________________,对比E和F中现象的差异可得出的结论及解释是________________________________。
(3)试管C和D中试剂各为_____________________________。
(4)装置G处发生反应的离子方程式为_______________________________。
(5)用离子方程式表示试剂X的作用_________________________。
(6)家庭中常用消毒液(主要成分NaClO)与洁厕灵(主要成分盐酸)清洁卫生。某品牌消毒液包装上说明如下图。

①“与洁厕灵同时使用”会产生有毒的氯气,写出反应的离子方程式__________________。
②需“密闭保存”的原因____________________________________________。
【答案】MnO2+4H++2Cl-![]() Mn2++Cl2↑+ 2H2O E中干布条不褪色,F中湿布条褪色 Cl2没有漂白性,HClO有漂白性 饱和食盐水、浓硫酸 Cl2+2I-=2Cl-+I2 Cl2+2OH-=Cl-+ClO-+ H2O Cl-+ ClO-+ 2H+= Cl2↑+ H2O NaClO溶液与空气中CO2反应生成HClO,HClO不稳定易分解。
Mn2++Cl2↑+ 2H2O E中干布条不褪色,F中湿布条褪色 Cl2没有漂白性,HClO有漂白性 饱和食盐水、浓硫酸 Cl2+2I-=2Cl-+I2 Cl2+2OH-=Cl-+ClO-+ H2O Cl-+ ClO-+ 2H+= Cl2↑+ H2O NaClO溶液与空气中CO2反应生成HClO,HClO不稳定易分解。
【解析】
实验室用浓盐酸与二氧化锰加热反应制备氯气,浓盐酸具有挥发性,制备的氯气中含有氯化氢、水,依次通过盛有饱和食盐水、浓硫酸的洗气瓶除去杂质,依次通过干燥有色布条、湿润有色布条验证氯气是否具有漂白性,再通过G装置验证氯气的氧化性,氯气有毒,能够与氢氧化钠溶液反应,可以用氢氧化钠溶液吸收尾气。据此分析解答。
(1)MnO2与浓盐酸在加热条件下发生氧化还原反应生成氯气、氯化锰和水,反应的方程式:MnO2+4H++2Cl-![]() Mn2++Cl2↑+ 2H2O;
Mn2++Cl2↑+ 2H2O;
(2)由于氯气本身没有漂白性,氯气与水反应产生了具有漂白性的HClO,而具有漂白性,所以看到的现象是:E中干燥的布条不褪色,F中湿润的布条褪色;
(3)在实验室中用浓盐酸与二氧化锰加热反应制备氯气,浓盐酸具有挥发性,使制备的氯气中混有杂质氯化氢、水蒸气,先通过盛有饱和食盐水的C装置除去HCl杂质,再通过盛有浓硫酸的D装置洗气瓶干燥氯气,除去水蒸气,就可防止水蒸气对氯气漂白性检验造成干扰,以便于检验氯气的性质;
(4)氯气具有强的氧化性,在溶液中与碘化钾反应生成单质碘,碘遇到淀粉变蓝,反应的离子方程式为Cl2+2I-=2Cl-+I2;
(5)氯气有毒不能直接排放到空气中,由于氯气能够与碱反应,产生容易溶于水的物质,所以可以用氢氧化钠溶液作吸收试剂,吸收过量的氯气,反应的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O;
(6) ①家庭中常用消毒液与洁厕灵混合,其中次氯酸根离子与氯离子在酸性条件下会发生氧化还原反应产生有毒的氯气,离子方程式:Cl-+ClO-+2H+=Cl2↑+H2O;
②由于酸性H2CO3>HClO,消毒液有效成分次氯酸钠与空气中的二氧化碳和水生成的次氯酸,次氯酸不稳定,见光容易分解,所以应该密封保存。


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:
【题目】为测定某有机化合物A的结构,进行如下实验。
[分子式的确定]
(1)将有机物A置于氧气流中充分燃烧,实验测得生成5.4 g H2O和8.8 g CO2,消耗氧气6.72 L(标准状况下)。则该物质中各元素的原子个数比是__________。
(2)质谱仪测定有机化合物的相对分子质量为46,则该物质的分子式是__________。
(3)根据价键理论,预测A的可能结构并写出结构简式_____________________。
[结构式的确定]
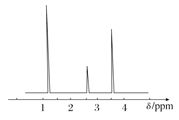
(4)经测定,有机物A的核磁共振氢谱如图所示,则A的结构简式为_____________。
[性质实验]
(5)A在Cu作用下可被氧化生成B,其化学方程式为___________________________。
(6)A可通过粮食在一定条件下制得,由粮食制得的A在一定温度下密闭储存,因为发生一系列的化学变化而变得更醇香。请写出最后一步反应的化学方程式:________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近美国宇航局(NASA)马里诺娃博士找到了一种比二氧化碳有效104倍的“超级温室气体”—全氟丙烷(C3F8),并提出用其“温室化火星”使其成为第二个地球的计划。有关全氟丙烷的说法正确的是 ( )
A. 分子中三个碳原子可能处于同一直线上
B. 全氟丙烷的电子式为: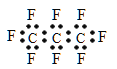
C. 相同压强下,沸点:C3F8<C3H8
D. 全氟丙烷分子中既有极性键又有非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用含少量银和锌的粗铜做阳极,纯铜片做阴极,CuSO4溶液做电解液,电解一段时间后,阳极质量减少了x g,则( )
A. 电解液质量增加x g B. 阴极质量增加x g
C. 阴极质量增加a g,a>x D. 阴极质量增加b g,b<x
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. 0.1 mol·L-1NaNO3溶液:H+、Fe2+、Cl-、SO42-、K+
B. ![]() =10-13mol·L-1的溶液:Na+、AlO2-、OH-、NO3-
=10-13mol·L-1的溶液:Na+、AlO2-、OH-、NO3-
C. 0.1 mol·L-1NH3·H2O溶液:K+、Na+、NO3-、Cl-
D. 加入铝粉能产生大量H2的溶液:Na+、K+、Cl-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应的实验,能达到实验目的的是
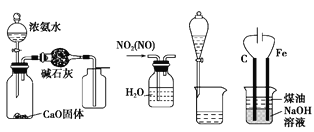
图1 图2 图3 图4
A. 用图1所示装置制取并收集干燥纯净的NH3
B. 用图2所示装置可除去NO2中的NO
C. 用图3所示装置可分离CH3COOC2H5和饱和碳酸钠溶液
D. 用图4所示装置制取Fe(OH)2,并较长时间观察其存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中的反应:3H2(g) + N2(g) ![]() 2NH3(g) △H<0,正反应速率随时间变化的情况如图所示,判断下列有关t1时刻条件变化的说法可能正确的是
2NH3(g) △H<0,正反应速率随时间变化的情况如图所示,判断下列有关t1时刻条件变化的说法可能正确的是

A. 其他条件不变,增大NH3浓度的同时减小N2浓度
B. 其他条件不变,再充入N2和H2
C. 其他条件不变,扩大容器的体积
D. 其他条件不变,降低反应温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)由下列实验及现象不能推出相应结论的是
实验 | 现象 | 结论 | |
A | 加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸 | 石蕊试纸变蓝 | NH4HCO3固体受热分解,产生的NH3与水反应生成的氨水显碱性 |
B | 向2支盛有1 mL相同浓度AgNO3溶液的试管中分别加入3滴相同浓度的KCl和KI溶液 | 一只试管中产生黄色沉淀,另一支中无明显现象 |
|
C | 向苯酚钠溶液中通入CO2 | 溶液变浑浊 | 相同条件下,碳酸的酸性一定比苯酚强 |
D | 用铂丝蘸取少量某溶液进行焰色反应 | 火焰呈黄色 | 证明该溶液中一定存在Na+和K+ |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些烃的分子结构模型如图所示。

回答下列问题:
(1) 属于比例模型的是_______(填“甲”、“乙”、“丙”、“丁”或“戊”,下同)。
(2)表示同一种有机化合物的是_______;
(3)存在同分异构体的是_______;写出其同分异构体的结构简式___________;
(4) C10H14属于苯的同系物的所有同分异构体共有_______种。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com