
【题目】某些烃的分子结构模型如图所示。

回答下列问题:
(1) 属于比例模型的是_______(填“甲”、“乙”、“丙”、“丁”或“戊”,下同)。
(2)表示同一种有机化合物的是_______;
(3)存在同分异构体的是_______;写出其同分异构体的结构简式___________;
(4) C10H14属于苯的同系物的所有同分异构体共有_______种。
【答案】 乙、丙 甲、丙 戊 CH3CH(CH3)CH2CH、C(CH3)4 22
【解析】试题分析:由图中各烃的分子结构模型可知,甲、乙、丙、丁、戊分别是甲烷、乙烷、甲烷、丙烷和戊烷(正戊烷)。
(1)属于比例模型的是乙、丙。
(2)表示同一种有机化合物的是甲、丙;
(3)存在同分异构体的是戊;其同分异构体有2种,即异戊烷和新戊烷,结构简式分别为CH3CH(CH3)CH2CH、C(CH3)4;
(4)C10H14属于苯的同系物的所有同分异构体,可以分类计算,①只有一个烷基,即丁基,丁基有4种结构,所以丁苯有4种;②有两个烷基,分为一个甲基、一个丙基或异丙基,两个取代基可以按邻、间、对3种形式排列,共有6种;当两个都是乙基,两个取代基可以按邻、间、对3种形式排列。此种情况总共有 9种;③有三个烷基,即2个甲基和 1个乙基。 首先2个甲基按邻、间、对3种形式排列,然后再安排乙基。甲基相邻时有2种、 甲基相间时有3种 、甲基相对时有1种,共有6种;④当为4个甲基时总共有3种。综上所述,4种情况总和22种。


科目:高中化学 来源: 题型:
【题目】实验室用如下装置制取氯气,并用氯气进行实验。回答下列问题:
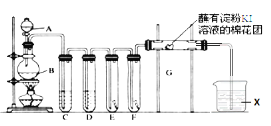
(1)A中盛有浓盐酸,B中盛有MnO2,写出反应的离子方程式__________________________。
(2)E中为红色干布条,F中为红色湿布条,可观察到的现象是________________________,对比E和F中现象的差异可得出的结论及解释是________________________________。
(3)试管C和D中试剂各为_____________________________。
(4)装置G处发生反应的离子方程式为_______________________________。
(5)用离子方程式表示试剂X的作用_________________________。
(6)家庭中常用消毒液(主要成分NaClO)与洁厕灵(主要成分盐酸)清洁卫生。某品牌消毒液包装上说明如下图。

①“与洁厕灵同时使用”会产生有毒的氯气,写出反应的离子方程式__________________。
②需“密闭保存”的原因____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如右图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为( )

A. 6:1 B. 3:1 C. 2:1 D. 1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】解释下列事实的方程式不正确的是( )
A. Al溶于NaOH溶液:2Al + 2H2O + 2NaOH ==2NaAlO2 + 3H2↑
B. 盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2 + 2OH-=SiO32- + H2O
C. 热的浓NaOH溶液与NH4Cl液混合产生气体:NH4+ + OH-![]() NH3↑+ H2O
NH3↑+ H2O
D. 实验室用NaOH溶液吸收多余的NO2:3NO2 +2OH—=2NO3—+H2O+NO↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,加热等物质的量的NaHCO3和Na2O2的固体混合物,充分反应后,容器中固体剩余物是( )
A. Na2CO3和Na2O2 B. Na2CO3和NaOH
C. NaOH和Na2O2 D. NaOH、Na2O2和Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知100℃时,水的离子积常数Kw=1×10-12,对于该温度下pH=l1的氨水,下列叙述正确的是
A. 向该溶液中加入同温同体积pH=1的盐酸,反应后溶液呈中性
B. 温度降低至25℃,该氨水溶液中H2O电离出的H+浓度小于10-11mol/L
C. 该氨水溶液中加入NH4Cl溶液,NH3·H2O的电离能力增强
D. 滴加等浓度等体积的硫酸,得到的溶液中存在电离平衡:NH4HSO4(aq)![]() NH4+(aq)+H+(aq)+SO42-(aq)
NH4+(aq)+H+(aq)+SO42-(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】处于平衡状态的反应2 H2 S(g) ![]() 2H2(g)+S2(g)
2H2(g)+S2(g) ![]() H>0,不改变其他条件的情况下合理的说法是
H>0,不改变其他条件的情况下合理的说法是
A.加入催化剂,反应途径将发生改变,![]() H也将随之改变
H也将随之改变
B.升高温度,正逆反应速率都增大,H2S分解率也增大
C.增大压强,平衡向逆反应方向移动,将引起体系温度降低
D.若体系恒容,注人一些H2后达新平衡,H2浓度将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿的主要成分是Al2O3,含有杂质SiO2、Fe2O3、MgO。工业上从铝土矿中提取铝可采用如下工艺流程:

请回答下列问题:
(1)沉淀B的成分是____________(填化学式,下同);
(2)沉淀C的成分是__________;
(3)沉淀F转化为物质M的化学方程式为 _____________________;
(4)溶液D中通入过量CO2生成沉淀F的离子方程式为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质:①氯气,②澄清石灰水,③水银,④稀盐酸,⑤氯化铜固体,⑥熔融氢氧化钠,⑦蔗糖,⑧酒精,⑨二氧化碳,⑩硫酸钡。其中属于电解质的是______(填序号,下面相同),属于非电解质的是_________,能导电的是_________。
(2)写出高锰酸钾受热分解制氧气的化学反应方程式____________________,反应中的氧化剂是________,还原产物是____________,当有2mol电子转移时,生成的氧气在标准状况下的体积是________L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com