
【题目】芳香酯I的合成路线如下: 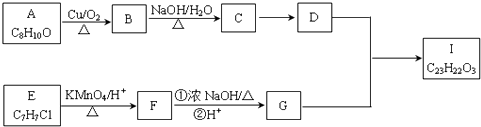
已知以下信息:
①A﹣I均为芳香族化合物,B苯环上只有一个取代基,B能银镜反应,D的相对分子质量
比C大4,E的核磁共振氢谱有3组峰.
② ![]()
③ ![]()
请回答下列问题:
(1)A→B的反应类型为 , D所含官能团的名称为 , E的名称为
(2)E→F与F→G的顺序能否颠倒(填“能”或“否”),理由 .
(3)B与银氨溶液反应的化学方程式为 .
(4)I的结构简式为 .
(5)符合下列要求A的同分异构体还有种.
①与Na反应并产生H2 ②芳香族化合物
(6)据已有知识并结合相关信息,写出以CH3CH2OH为原料制备CH3CH2CH2CH2OH的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
【答案】
(1)氧化反应;羟基、羧基;4﹣氯甲苯
(2)否;如果颠倒,则(酚)羟基会被KMnO4/H+氧化
(3)![]()
(4)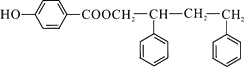
(5)13
(6)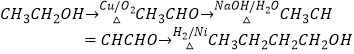
【解析】解:A﹣I均为芳香族化合物,B的苯环上只有一个取代基,根据A的分子式可知A的侧链为饱和结构,A能够催化氧化生成B,B能够发生银镜反应,且能够发生信息③中反应,则B分子中侧链﹣CH2CHO结构,故B的结构简式为 ![]() ,A为
,A为 ![]() ,则C为
,则C为 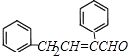 ,D比C的相对分子质量大4,恰好为2分子氢气,则说明C与氢气发生加成反应生成D,故D为
,D比C的相对分子质量大4,恰好为2分子氢气,则说明C与氢气发生加成反应生成D,故D为 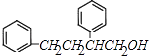 ;E的核磁共振氢谱有3组峰,E能够被酸性高锰酸钾溶液氧化,则E分子中含有甲基,且氯原子位于甲基的对位,故E为
;E的核磁共振氢谱有3组峰,E能够被酸性高锰酸钾溶液氧化,则E分子中含有甲基,且氯原子位于甲基的对位,故E为 ![]() ;E被酸性高锰酸钾溶液氧化成F,则F为
;E被酸性高锰酸钾溶液氧化成F,则F为 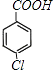 ;F在浓NaOH溶液中加热发生水解反应生成酚羟基,酚羟基、羧基与氢氧化钠发生中和反应,然后在酸性条件下转化成G,则G为
;F在浓NaOH溶液中加热发生水解反应生成酚羟基,酚羟基、羧基与氢氧化钠发生中和反应,然后在酸性条件下转化成G,则G为 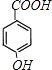 ,G和D发生酯化反应生成I,则I为
,G和D发生酯化反应生成I,则I为 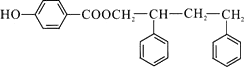 .(1)A→B为
.(1)A→B为 ![]() 催化氧化生成
催化氧化生成 ![]() ,该反应为氧化反应;G为
,该反应为氧化反应;G为 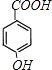 ,其分子中含有官能团为羟基、羧基,E为
,其分子中含有官能团为羟基、羧基,E为 ![]() ,名称为4﹣氯甲苯,所以答案是:氧化反应;羟基、羧基; 4﹣氯甲苯;(2)E到G的反应中需要分别引进酚羟基和羧基,由于酚羟基容易被酸性高锰酸钾溶液氧化,所以E→F与F→G的顺序不能颠倒,
,名称为4﹣氯甲苯,所以答案是:氧化反应;羟基、羧基; 4﹣氯甲苯;(2)E到G的反应中需要分别引进酚羟基和羧基,由于酚羟基容易被酸性高锰酸钾溶液氧化,所以E→F与F→G的顺序不能颠倒,
所以答案是:否;如果颠倒,则(酚)羟基会被KMnO4/H+氧化;(3)B分子中含有醛基,能够与与银氨溶液发生反应生成单质银,反应的化学方程式为: ![]() ,
,
所以答案是: ![]() ;(4)G和D发生酯化反应生成I,I的结构简式为:
;(4)G和D发生酯化反应生成I,I的结构简式为: 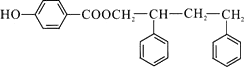 ,
,
所以答案是: 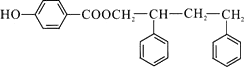 ;(5)A为
;(5)A为 ![]() ,其同分异构体符合:①与Na反应并产生H2 , 说明该有机物分子中含有羟基;②芳香族化合物,有机物分子中含有苯环,满足条件的有机物分子中可能含有的侧链为:①﹣CH(OH)CH3 , ②﹣OH、﹣CH2CH3 , ③1个﹣CH3 , 1个﹣CH2OH,④1个﹣OH、2个﹣CH3 , 其中①存在1种结构,②③都存在邻、间、对3种结构,④当3个取代基都在间位时存在1种结构,当3个取代基相邻时存在2种结构,当有2个取代基相邻时有3种结构,所以④总共有6种结构,
,其同分异构体符合:①与Na反应并产生H2 , 说明该有机物分子中含有羟基;②芳香族化合物,有机物分子中含有苯环,满足条件的有机物分子中可能含有的侧链为:①﹣CH(OH)CH3 , ②﹣OH、﹣CH2CH3 , ③1个﹣CH3 , 1个﹣CH2OH,④1个﹣OH、2个﹣CH3 , 其中①存在1种结构,②③都存在邻、间、对3种结构,④当3个取代基都在间位时存在1种结构,当3个取代基相邻时存在2种结构,当有2个取代基相邻时有3种结构,所以④总共有6种结构,
根据以上分析可知,满足条件的有机物总共有:1+3+3+6=13种,
所以答案是:13;(6)CH3CH2OH为原料制备CH3CH2CH2CH2OH,先将乙醇催化氧化生成乙醛,然后让乙醛发生信息反应③生成CH3CH=CHCHO,与氢气加成生成CH3CH2CH2CH2OH,所以合成流程为 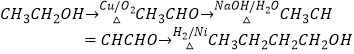 ,
,
所以答案是: 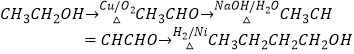 .
.


科目:高中化学 来源: 题型:
【题目】实验室里常用Na2O2与H2O反应快速制取少量的O2,下面装置用来制取O2并演示Na在O2中的燃烧实验。
(1)关闭装置中的止水夹a后,开启活塞b,漏斗中液体不断地往下滴,直至全部流入试管。试判断装置是否漏气________(填“漏气”、“不漏气” 或“无法确定”)
(2)写出C装置中反应的化学方程式:_________
(3)若装置是不漏气的,打开止水夹a后,用上述装置进行实验。写出A中发生反应的化学方程式,并用双线桥标出化合价变化情况、电子转移的方向和数目及被氧化还原情况 _________
(4)B装置中盛放的试剂是__________,其作用是___________ D仪器名称是 _____
(5)Fe(OH)2 在潮湿空气中变成灰绿色、红褐色:_________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是向MgCl2、AlCl3混合溶液中,开始滴加7 mL试剂A,之后改滴加试剂B,所得沉淀物质的量y (mol) 与试剂体积V(mL)间的关系如图所示。(试剂A、B分别是NaOH 溶液盐酸中的一种)
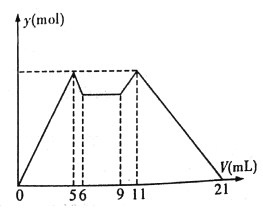
以下结论不正确的是
A. A是NaOH 溶液,B是盐酸
B. 原混合液中,c(Al3+) :c(Mg2+) :c(Cl-)=1:1:5
C. c(NaOH) :c(HCl)=1:2
D. 从6 到9 的过程中,发生的反应的离子反应方程式是H+ +OH-=H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅单质及其化合物应用范围很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
![]()
①写出由石英砂和焦炭在高温下制备粗硅的化学反应方程式:_____________。
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种气体,写出配平的化学反应方程式: _____________;H2还原SiHCl3过程中若混入O2,可能引起的后果是______________。
(2)下列有关硅材料的说法正确的是_____________ (填字母代号)。
A.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
B.石英坩埚耐高温性强,可用于加热熔融氢氧化钠
C.神舟10号飞船所用太阳能电池板可将光能转换为电能,所用转换材料单晶硅也可以制作电脑芯片
D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
E.盐酸可以与硅反应,故可采用盐酸为抛光液抛光单晶硅
F.玛瑙饰品的主要成分与建筑材料砂子相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知KMnO4、MnO2在酸性条件下均能将草酸 (H2C2O4)氧化:
( i)MnO4﹣+H2C2O4+H+→Mn2++CO2↑+H2O(未配平)
( ii)MnO2+H2C2O4+2H+=Mn2++2CO2↑+2H2O
某研究小组为测定某软锰矿中MnO2的质量分数,准确称取1.20g软锰矿样品,加入1.80g草酸,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应之后冷却、滤去杂质,将所得溶液转移到容量瓶中并定容;从中取出25.00mL待测液置于锥形瓶中,再用0.020molL﹣1KMnO4标准溶液进行滴定,当滴入20.00mLKMnO4溶液时恰好完全反应.试回答下列问题:
①方程式( i)配平后H2C2O4的计量系数为 .
②0.020molL﹣1KMnO4标准溶液应置于(填“甲”或“乙”)滴定管中;滴定终点的颜色变化是 .
③你能否帮助该研究小组求得软锰矿中MnO2的质量分数;若“能”,请给出计算结果;若“否”,试说明原因.“能”的计算结果或“否”的原因说明 .
④若在实验过程中存在下列操作,其中会使所测MnO2的质量分数偏小的是 .
A.滴定前尖嘴部分有一气泡,滴定终点时消失
B.溶液转移至容量瓶中,未将烧杯、玻棒洗涤
C.滴定前仰视读数,滴定后俯视读数
D.定容时,俯视刻度线
E.锥形瓶水洗之后未用待测液润洗.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用。实验室制取氯气除了用浓盐酸和二氧化锰反应外还可利用下列反应:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,该反应的优点是反应产生氯气速度快、不需加热。请你根据所学知识回答下列问题:
(1)上述反应中____是氧化剂,该反应中氧化产物与还原产物的物质的量之比为____。
(2)把氯气通入紫色石蕊溶液中,可以观察到的现象是:______________________。
(3)实验室配制好2.0 mol·L-1的NaOH溶液,需要这种溶液____mL才能与2.24 L氯气(标准状况)恰好完全反应。
(4)已知Br2的水溶液因浓度不同而呈现橙色或红棕色,NaBr溶液中缓缓通入Cl2时,可以看到无色溶液逐渐变为红棕色,请写出对应的离子方程式______________。
(5)现需490 mL 2.0 mol·L-1 NaOH溶液:
①所需称量的氢氧化钠固体的质量是____。
②上述实验需要的仪器有天平(含砝码)、药匙、烧杯、量筒、玻璃棒、胶头滴管、______。
③在配制溶液的过程中,下列操作可能造成结果偏高的是____。
A.定容时俯视
B.容量瓶不干燥,含有少量蒸馏水
C.溶解所用烧杯未洗涤
D.NaOH溶解后,未冷却即进行实验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,给一氧化碳和水蒸气的气体混合物加热,在催化剂存在下发生反应:CO(g)+H2O(g)H2(g)+CO2(g).在500℃时,平衡常数K=9.若反应开始时,一氧化碳和水蒸气的浓度都是0.02mol/L,则在此条件下CO的转化率为( )
A.25%
B.50%
C.75%
D.80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若将阿伏加德罗常数规定为0.024kg12C中所含有的C原子数,而其他概念和规定一律不变,则下列各项的数值不会发生变化的是( )
A.物质的量
B.相对原子质量
C.物质的摩尔质量
D.12g12C中所含有的C原子数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com