
【题目】三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料,对于反应2SiHCl3(g)![]() SiH2Cl2(g) +SiCl4(g),应速率v=v正-v逆=k正x2SiHCl3-k逆xSiH2Cl2xSiCl4,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,采用大孔弱碱性阴离子交换树脂催化剂,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。下列说法错误的是( )
SiH2Cl2(g) +SiCl4(g),应速率v=v正-v逆=k正x2SiHCl3-k逆xSiH2Cl2xSiCl4,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,采用大孔弱碱性阴离子交换树脂催化剂,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。下列说法错误的是( )

A.该反应的正反应活化能大于逆反应活化能
B.a、b处反应速率大小:va大于vb
C.温度一定时使用更优质催化剂,可使k正、k逆增大,k正与k逆的比值增大
D.343K时反应的平衡常数K=![]()
【答案】C
【解析】
根据达到平衡所需时间可知a所在曲线的温度更高,故a所在曲线的温度为343K,b所在曲线的温度为323K,进一步分析可知温度越高SiHCl3的转化率越高,即温度升高平衡右移,正反应吸热,![]() >0;
>0;
A. 根据分析可知![]() =正反应活化能-逆反应活化能>0,故A正确;
=正反应活化能-逆反应活化能>0,故A正确;
B.根据分析可知a点温度高于b点,温度越高反应速率越快,故B正确;
C. v正-v逆=k正x2SiHCl3-k逆xSiH2Cl2xSiCl4,反应达到平衡时正逆反应速率相等,即k正x2SiHCl3= k逆xSiH2Cl2xSiCl4,经变换可得平衡常数K=k正/k逆,即温度不变k正与k逆的比值不变,故C错误;
D. 由图示可知343K时反应2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g)的平衡转化率α=22%,设SiHCl3的起始浓度为cmol/L,则
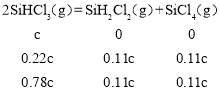
平衡常数![]() =
=![]() ;故D正确;
;故D正确;
故答案为C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
[实验原理] 2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+10CO2↑+8H2O
[实验内容及记录]
实验 编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | ||
1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
3 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
请回答:
(1)根据上表中的实验数据,可以得到的结论是___________________________。
(2)利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率为v(KMnO4)=_____________________________。
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设。并继续进行实验探究。
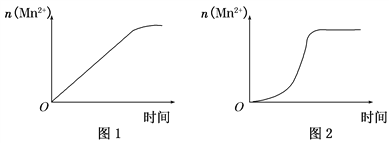
①该小组同学提出的假设是____________________________________。
②请你帮助该小组同学完成实验方案,并填写表中空白。
实验 编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L稀硫酸 | |||
4 | 3.0 | 2.0 | 3.0 | 2.0 | ________ | t |
③若该小组同学提出的假设成立,应观察到的现象是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将0.2mol/LKMnO4酸性溶液0.1L与一定量pH=3的草酸(HOOC—COOH)溶液混合,放出VL气体。NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.0.1molHOOC—COOH含共用电子对数目为0.9NA
B.当1molKMnO4被还原时,强酸提供的H+数目为NA
C.pH=3的草酸溶液含有H+数目为0.001NA
D.该反应释放CO2分子数目为![]() NA
NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某化学反应的平衡常数表达式为K=![]() ,在不同的温度下该反应的平衡常数如下表,下列有关叙述不正确的是
,在不同的温度下该反应的平衡常数如下表,下列有关叙述不正确的是
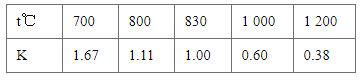
A.该反应的化学方程式是CO(g)+H2O(g)CO2(g)+H2(g)
B.上述反应的正反应是放热反应
C.若在1 L的密闭容器中通入CO2和H2各1 mol,5 min后温度升高到830 ℃,此时测得CO2为0.4 mol,该反应达到平衡状态
D.若平衡浓度符合关系式![]() =
=![]() ,则此时的温度为1000 ℃
,则此时的温度为1000 ℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表为元素周期表短周期的一部分,下列有关A、B、C、D四种元素的叙述正确的是( )

A.原子半径大小比较为D>C>B>A
B.生成的氢化物分子间均可形成氢键
C.A与C形成的阴离子可能有AC32-、A2C42-
D.A、B、C、D的单质常温下均不导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图所示示意图,下列说法不正确的是

A. 反应的热化学方程式可表示为C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=(b-a) kJ·mol-1
CO(g)+H2(g) ΔH=(b-a) kJ·mol-1
B. 该反应过程反应物断键吸收的能量大于生成物成键放出的能量
C. a mol C和a mol H2O反应生成a mol CO和a mol H2吸收的热量一定为131.3a kJ
D. 1 mol C(g)、2 mol H、1 mol O转变成1 mol CO(g)和1 mol H2(g)放出的热量为a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有硫酸铁、硫酸亚铁和硫酸混合溶液200mL,现将其分成两等份,往其中一份中滴加足量BaCl2溶液,产生25.63g白色沉淀,往另一份中投入足量铁片,放出1.12L气体(标准状况)。下列判断错误的是( )
A.原溶液中离子有3c(Fe3+)+c(H+)+2c(Fe2+)=2c(SO42-)+c(OH-)
B.原混合液中c(Fe3+)可能为0.1molL-1
C.原混合液中c(H+)=0.5molL-1
D.溶解的铁最多不超过3.92g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某氨水中加入醋酸溶液,反应方程式如下:NH3·H2O+CH3COOH=CH3COONH4+H2O滴加过程,溶液的导电能力(I)与加入醋酸溶液的体积(V)关系正确的是( )
A.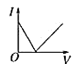 B.
B.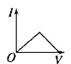 C.
C.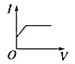 D.
D.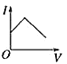
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,装置Ⅰ为新型电池,放电时B电极的反应式为NaBr3+2Na++2e-=3NaBr,装置Ⅱ为铅蓄电池。首先闭合K1和K2,当铅蓄电池充电结束后,断开K1,闭合K2。下列说法正确的是

A.装置Ⅰ放电时的A电极反应式为2Na2S2-2e-=Na2S4+2Na+
B.闭合K1、K2时,每有0.1molNa+通过离子交换膜,装置Ⅱ溶液中有0.1mol电子转移
C.断开K1、闭合K2时,b电极的电极反应式为PbO2+2e-+SO42-+4H+=PbSO4+2H2O
D.断开K1、闭合K2时,装置Ⅱ中SO42-向a电极迁移
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com