
【题目】2008年5月我国汶川发生地震灾害,假若你是卫生防疫人员,为配制0.01 mol/L的KMnO4消毒液,下列操作导致所配溶液浓度偏高的是( )
A. 取KMnO4样品时不慎在表面沾了点蒸馏水
B. 溶解搅拌时有液体飞溅
C. 定容时俯视容量瓶刻度线
D. 摇匀后见液面下降,再加水至刻度线
科目:高中化学 来源: 题型:
【题目】25℃时,用0.0500 mol·L-1H2C2O4(二元弱酸)溶液滴定 25.00 mL 0.100 0 mol L-1NaOH溶液所得滴定曲线如右图。下列说法正确的是( )

A. 点①所示溶液中:c(H+)+c(H2C2O4)+ c(HC2O4-)=c(OH-)
B. 点②所示溶液中:c(HC2O4-)+c(C2O42-)=c(Na+)
C. 点③所示溶液中:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
D. 滴定过程中可能出现:c(Na+) > c(C2O42-) =c(HC2O4-)>C(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在粗制CuSO45H2O晶体中常含有杂质Fe2+。
①在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是____________
A.KMnO4 B.H2O2 C.氯水 D.HNO3
②然后再加入适当物质调整溶液至pH=4,使Fe3+转化为Fe(OH)3,调整溶液pH可选用下列中的____________
A.NaOH B.NH3H2O C.CuO D.Cu(OH)2
(2)甲同学怀疑调整溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 molL-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0molL-1,则Cu(OH)2开始沉淀时溶液的pH为____________,Fe3+完全沉淀[即c(Fe3+)≤1×10-5 molL-1]时溶液的pH为____________,通过计算确定上述方案_____________ (填“可行”或“不可行”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在透明溶液中,不能大量共存的离子组是( )AC
A.Cu2+、Na+、SO42-、Cl- B.K+、Na+、HCO3-、NO3-
C.OH-、HCO3-、Ca2+、Na+ D.Ba2+、Na+、OH-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环乙烯是一种重要的化工原料,实验室常用下列反应制备环乙烯:

环己醇、环己烯的部分物理性质见下表:
物质 | 沸点(℃) | 密度(g·cm-3,20℃) | 溶解性 |
环己醇 | 161.1(97.8)* | 0.9624 | 能溶于水 |
环己烯 | 83(70.8)* | 0.8085 | 不溶于水 |
*括号中的数据表示该有机物与水形成的具有固定组成的混合物中有机物的质量分数
Ⅰ:制备环己烯粗品。实验中将环己醇与浓硫酸混合加入烧瓶中,按图所示装置,油浴加热,蒸馏约1h,收集馏分,得到主要含环己烯和水的混合物。

Ⅱ:环己烯的提纯。主要操作有;
a.向馏出液中加入精盐至饱和;
b.加入3~4mL5%Na2CO3溶液;
c.静置,分液;
d.加入无水CaCl2固体;
e.蒸馏
回答下列问题:
(1)油浴加热过程中,温度控制在90℃以下,蒸馏温度不宜过高的原因是________。
(2)蒸馏不能彻底分离环己烯和水的原因是_______________。
(3)加入精盐至饱和的目的是_____________________。
(4)加入3~4mL5%Na2CO3溶液的作用是__________。
(5)加入无水CaCl2固体的作用是______________。
(6)利用核磁共振氢谱可以鉴定制备的产物是否为环己烯,环己烯分子中有_______种不同环境的氢原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中需要2mol/L的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取NaCl质量分别是( )
A. 950mL,111.2g B. 950mL,117.0g
C. 1000mL,117.0g D. 1000mL,111.2g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化钙晶体(CaBr2·2H2O)为白色固体,易溶于水,可用于制造灭火剂、制冷剂等。一种制备溴化钙晶体的工艺流程如下:
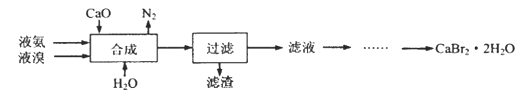
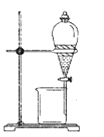
(1)实验室模拟海水提溴的过程中,用苯萃取溶液中的溴,分离溴的苯溶液与水层的操作是(装置如下图):使玻璃塞上的凹槽对准漏斗上的小孔,将活塞拧开,使下面的水层慢慢流下,待有机层和水层界面与活塞上口相切即关闭活塞,______________。
(2)“合成”的化学方程式为___________________。 “合成”温度控制在70℃以下,其原因是__________。投料时控制n(Br2):n(NH3)= 1:0.8,其目的是__________________。
(3)“滤渣”的主要成分为_________________(填化学式)。
(4)“滤液”呈强碱性,其中含有少量BrO-、BrO3-,请补充从“滤液”中提取CaBr2·2H2O的实验操作:加热驱除多余的氨,______________。[实验中须使用的试剂有:氢溴酸、活性炭、乙醇;除常用仪器外须使用的仪器有:砂芯漏斗,真空干燥箱]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出9种元素在周期表中的位置,请按要求回答问题。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
4 | ⑨ |
(1)⑦的简单离子的结构示意图是______。表中标注的元素的最高价氧化物对应的水化物中碱性最强的碱是_____(填写化学式)。③、④、⑨三种元素按原子半径由大到小的顺序排列为 ______ (用元素符号表示)。
(2)元素②的气态氢化物的电子式是_______。由3个元素②的原子组成带一个单位负电荷的阴离子中含有_______个电子。写出该元素氢化物与其最高价氧化对应水化物反应的离子方程
式_____________。
(3)⑦、⑧两元素简单离子还原性强弱为______(填离子符号)。
(4)某研究性学习小组设计了一组实验验证元周期律。
Ⅰ:甲同学在A、B两只烧杯里分别加入50mL水,再分别滴加几滴酚酞溶液,依次加入大小相近的③、⑨元素单质,观察现象。甲同学设计实验的目的是_____。写出元素⑨的单质与水反应的化学方程式为________。
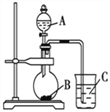
Ⅱ:乙同学设计如图装置以验证①、⑥、⑦元素的非金属性强弱。为了达到实验目的,仪器A、B、C分别选择的药品为A______、B______、C______;烧杯中发生反应的离子方程式为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com