
| A. | 一定条件下能与液溴发生取代反应 | B. | 能与溴水反应而褪色 | ||
| C. | 苯存在单双建交替结构 | D. | 苯不能发生加成反应 |
分析 苯是一种不饱和的烃,但并不是单双键交替的结构,由于无碳碳双键,故不能和溴水发生加成反应,但能和液溴发生取代反应,由于是不饱和烃,故能和氢气发生加成反应,据此分析.
解答 解:A、苯能和液溴在溴化铁做催化剂的条件下发生取代反应生成溴苯,故A正确;
B、苯中不含碳碳双键,故不能和溴水发生反应而使溴水褪色,故B错误;
C、苯不是单双键交替的结构,在结构中无碳碳双键,苯中的键是介于单双键之间的特殊的键,故C错误;
D、苯是不饱和的烃,故能发生加成反应,但不能喝溴水加成,只能和氢气加成,故D错误.
故选A.
点评 本题考查了苯的结构和化学性质,难度不大,应注意的是苯只能和氢气加成,和溴水不反应.


科目:高中化学 来源: 题型:实验题

| 金属 | 电压表指针偏转方向 | 电压/V |
| Al | 指向Cu | +0.78 |
| 甲 | 指向甲 | -0.15 |
| 乙 | 指向Cu | +1.35 |
| Fe | 指向Cu | +0.30 |
| 丙 | 指向Cu | +0.45 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为8、中子数为10的氧原子:${\;}_{8}^{18}$O | |
| B. | Ga的原子结构简图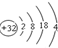 | |
| C. | 水分子的电子式: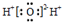 | |
| D. | 乙酸甲酯的结构简式:HCOOC2H5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为水果中一般含有各种芳香族有机酸,食用时能感到较强的酸味,刺激食欲 | |
| B. | 猪肉因含有 而有香味,该物质属于烃的衍生物,能发生加聚反应 而有香味,该物质属于烃的衍生物,能发生加聚反应 | |
| C. | 除去苯中 的方法:加溴水,充分振荡,静置分液 的方法:加溴水,充分振荡,静置分液 | |
| D. | 在分子筛固体酸作催化剂的条件下,用苯和丙烯反应制备异丙苯,符合绿色化学工艺 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol•L-1•min-1 | B. | 2.5mol•L-1•min-1 | ||
| C. | 2mol•L-1•min-1 | D. | 5mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素 | 结构或性质信息 |
| X | 其原子最外层电子数是内层电子数的2倍 |
| Y | 基态原子最外层电子排布为nsnnpn+1 |
| Z | 非金属元素,其单质为固体,在氧气中燃烧时有明亮的蓝紫色火焰 |
| M | 单质在常温、常压下是气体.基态原子的M层上有1个未成对的p电子 |
| Q | 其与X形成的合金为目前用量最多的金属材料 |
 .
. 键和π键数目之比为1:1.
键和π键数目之比为1:1.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com