
【题目】γ-Fe2O3在磁性、催化、气敏等方面用途非常广泛,以硫铁矿烧渣(含Fe2O3、SiO2、CaO、Al2O3等)为原料生产γ-Fe2O3的流程如下:

(1)“还原焙烧”时,焦炭的作用是______________,起还原作用的主要物质是__________(填化学式)。
(2)“浸取”时,为提高铁的浸取率,可采取的措施除粉碎焙烧后的熔体、适当增大硫酸的用量外,还可采取的措施有______________(任写一条)。
(3)“过滤”前,将溶液的pH调至5~5.5的目的是将Al3+转化为___________(填化学式)。
(4)“缓慢干燥”生成铁黄的化学方程式为_____________。
(5)经上述流程制得的γ-Fe2O3中含有少量FeO和Al2O3杂质,某课题小组称取8.1380gγ-Fe2O3样品,溶于100mL2.00mol/LH2SO4溶液中,完全溶解后加入过量H2O2溶液,然后加入1.00mol/L的NaOH溶液,生成固体的质量与加入NaOH溶液体积的关系如图,则该样品中γ-Fe2O3的百分含量为___________(百分数保留到小数点后两位)。

【答案】
(1)燃烧提供热量和产生还原剂(2分);CO(1分)
(2)充分搅拌(或适当延长浸取时间等其他合理答案)(1分)
(3)Al(OH)3(1分)
(4)4Fe(OH)2+O2=4FeOOH+2H2O(2分)
(5)98.30%(2分)
【解析】
试题分析:(1)“还原焙烧”时,焦炭与氧气反应产生CO作还原剂,将三价铁转化为二价铁。所以焦炭的作用是燃烧提供热量和产生还原剂,起还原作用的主要物质是CO。
(2)“浸取”时,为提高铁的浸取率,可采取的措施除粉碎焙烧后的熔体、适当增大硫酸的用量外,还可以充分搅拌、适当延长浸取时间等。
(3)硫铁矿烧渣中含Fe2O3、SiO2、CaO、Al2O3等,应将SiO2、CaO、Al2O3等杂质处理除去,所以将溶液的pH调至5~5.5,目的是将Al3+转化为Al(OH)3。
(4)硫酸亚铁溶液加入氨水后转化为Fe(OH)2,在氧气作用下转化为铁黄FeOOH,所以“缓慢干燥”生成铁黄的化学方程式为4Fe(OH)2+O2=4FeOOH+2H2O。
(5)在样品中加入H2SO4溶液后发生的反应有Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O,FeO + H2SO4 = FeSO4 + H2O,Al2O3 + 3H2SO4 = Al2(SO4)3 + 3H2O。再加入过量H2O2溶液将Fe2 + 氧化为Fe3 + 。由图像可知,O→A为NaOH中和过量的H2SO4,A→B为Al3+、Fe3+生成Al(OH)3、Fe(OH)3沉淀,B→C为Al(OH)3溶解。最后剩余的固体只有Fe(OH)3沉淀。B→C固体质量减少10.9095-10.7535=0.156g,即Al(OH)3为0.156g,为0.002mol,根据铝元素守恒,可得为Al2O3为0.001mol,质量为0.078g。最后剩余的固体只有Fe(OH)3沉淀,质量为10.7535g,为0.1005mol,即铁元素总物质的量为0.1005mol。100mL2.00mol/LH2SO4为0.2mol,与0.001molAl2O3反应用掉0.003mol,与93mL1.00mol/L的NaOH反应用掉0.0465mol,则与FeO和Fe2O3反应共用H2SO4为0.2mol-0.003mol-0.0465mol=0.1505mol。设Fe2O3为amol,则FeO为(0.1005-2a)mol,根据反应方程式可得3a+(0.1005-2a)=0.1505。求解可得a=0.05mol。则该样品中γ-Fe2O3的百分含量为![]() =98.30%。
=98.30%。


科目:高中化学 来源: 题型:
【题目】

(1)该硫酸的物质的量浓度是________mol/L。
(2)某化学兴趣小组进行硫酸性质的实验探究时,需要490 mL 4.6 mol/L的稀硫酸,则需要取________mL的该硫酸。
(3)配制时,所需的玻璃仪器除量筒、烧杯、玻璃棒和胶头滴管之外,还需要 (填仪器名称);
(4)配制溶液有如下(未按顺序排列):a.溶解,b.摇匀,c.洗涤,d.冷却,e.称量,f.将溶液移至容量瓶,g.定容等操作。其中摇匀的前一步操作是 ;(填写字母)
(5)在下列配制过程示意图中,有错误的是(填写序号) 。
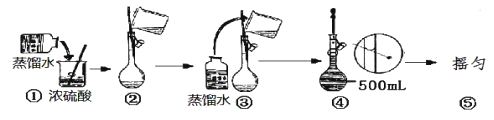
(6)在配制4.6 mol/L的稀硫酸的过程中,下列情况会引起硫酸溶液物质的量浓度偏高的是
A.未经冷却趁热将溶液注入容量瓶中 | B.容量瓶洗涤后,未经干燥处理 |
C.定容时仰视观察液面 | D.未洗涤烧杯和玻璃棒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
①参加反应的物质本身的性质是影响化学反应速率的主要因素 ②光是影响某些化学反应速率的外界条件之一 ③决定化学反应速率的主要因素是浓度 ④不管什么反应,增大浓度、加热、加压、使用催化剂都可以加快反应速率
A.①② B.②③ C.③④ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活息息相关,以下说法不正确的是
A.集中处理废旧电池,以防止重金属污染环境
B.海产品中加入大量甲醛以延长保鲜期
C.食用蔬菜水果可以补充人体所需维生素
D.使用加碘盐,可预防因缺碘引起的甲状腺肿大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有以下四种物质 ①22g二氧化碳;②5g氢气;③1.204╳1024个氮气分子; ④4℃时18g水,它们所含分子数最多的是 ;质量最大的是 ;常温时体积最大的是 (填序号)。
(2)已知反应
①SO3+H20=H2SO4
②Cl2+H2O=HCl+HClO
③2F2+2H2O=4HF+O2
④2Na+2H2O=4NaOH+H2↑
⑤SiO2+2NaOH=Na2SiO3+H2O
上述反应中不属于氧化还原反应的是 (填序号,下同);属于氧化还原反应,其中H2O被氧化的是____ _ ;H2O被还原的是_ ;属于氧化还原反应,但H2O既不被氧化,也不被还原的是 。
(3)现有下列十种物质:
①蔗糖 ②熔融NaCl ③盐酸 ④铜丝 ⑤NaOH固体 ⑥SO2 ⑦CuSO4固体 ⑧K2O固体 ⑨液态H2SO4⑩液氯
上述物质中可导电的是 (填序号,下同);上述物质中不能导电,但属于电解质的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)+Cl2(g)===2HCl(g) ΔH=-184.6 kJ·mol-1,则反应:HCl(g)===1/2H2(g)+1/2Cl2(g)的ΔH为( )
A.+184.6 kJ·mol-1 B.-92.3 kJ·mol-1
C.-369.2 kJ·mol-1 D.+92.3 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用碳酸钠晶体(Na2CO310H2O),配制0.2mol/L的Na2CO3溶液480mL。
(1)所需主要仪器为:药匙、托盘天平、烧杯、玻璃棒、_________和胶头滴管。
(2)本实验所需称量碳酸钠晶体(Na2CO310H2O)_________g;
(3)根据下列操作对所配溶液的浓度产生的影响,完成下列要求。
①Na2CO310H2O晶体失去了部分结晶水
②用“左码右物”的称量方法称量晶体
③碳酸钠晶体不纯,其中混有氯化钠
④称量碳酸钠晶体时所用砝码生锈
⑤容量瓶未经干燥就使用
其中引起所配溶液浓度偏高的有_________,偏低的有__________,无影响的有_________。(填序号)
(4)某同学改用固体Na2CO3配制上述Na2CO3溶液的过程如图所示:
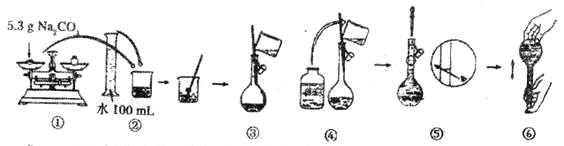
你认为该同学的操作步骤中错误(包含遗漏)之处有___________。
A.1处 | B.2处 | C.3处 | D.4处 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在同温同压下,下列各组热化学方程式中△H1>△H2的是( )
A.2H2(g)+O2(g)═2H2O(l);△H1 2H2(g)+O2(g)═2H2O(g);△H2
B.S(g)+O2(g)═2SO2(g);△H1 S(s)+O2(g)═2SO2(g);△H2
C.C(s)+![]() O2(g)═CO(g);△H1 C(s)+O2(g)═CO2(g);△H2
O2(g)═CO(g);△H1 C(s)+O2(g)═CO2(g);△H2
D.H2(g)+Cl2(g)═2HCl(g);△H1 ![]() H2(g)+
H2(g)+![]() Cl2(g)═HCl(g);△H2
Cl2(g)═HCl(g);△H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com