
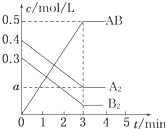
 一定条件下,在一个容积为2L的密闭容器中加入0.8mol A2气体和0.6mol B2气体反应达平衡生成1mol AB气体并释放出热量,反应中各物质的浓度随时间的变化情况如图所示.下列说法不正确的是( )
一定条件下,在一个容积为2L的密闭容器中加入0.8mol A2气体和0.6mol B2气体反应达平衡生成1mol AB气体并释放出热量,反应中各物质的浓度随时间的变化情况如图所示.下列说法不正确的是( )| A、图中a点的值为0.15 |
| B、该反应的平衡常数K=0.03 |
| C、温度升高,平衡常数K值减小 |
| D、平衡时A2的转化率为62.5% |
| c 2(AB) |
| c(A 2)c(B 2) |
| 0.52 |
| 0.15×0.05 |
| 100 |
| 3 |
| 0.25 |
| 0.4 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 氢氧化钠溶液 | 分液 |
| B | 甲烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| C | 乙酸乙酯(乙酸) | 碳酸钠溶液 | 分液 |
| D | 乙炔(硫化氢) | 硫酸铜 | 洗气 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
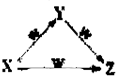 X、Y、Z、W四种物质之间有如图所示的转化关系(部分物质未写全),则X、Y可能是( )
X、Y、Z、W四种物质之间有如图所示的转化关系(部分物质未写全),则X、Y可能是( )| A、①②③④ | B、①②④ |
| C、③④ | D、①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | Z | |
| A | 雾 | 胶体 | 纯净物 |
| B | 金属氧化物 | 碱性氧化物 | 氧化物 |
| C | 碱 | 电解质 | 化合物 |
| D | 置换反应 | 氧化还原反应 | 离子反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、400mL1mol/L 盐酸 |
| B、200mL 2.5mol/L MgCl2溶液 |
| C、300mL 2mol/L AlCl3溶液 |
| D、100mL 3mol/L NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用氯气消毒浴池 |
| B、用稀盐酸除去热水瓶胆壁上的水垢(主要成分是CaCO3) |
| C、用食盐腌渍食物 |
| D、用小苏打治疗胃酸过多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶解 |
| ① |
| BaCl2 |
| ② |
| NaOH |
| ③ |
| ④ |
| 过滤 |
| ⑤ |
| 适量盐酸 |
| ⑥ |
| 蒸发、结晶 |
| 干燥 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com