
【题目】下列实验与对应的图象不符合的是( )
A.①向一定体积的氢氧化钠溶液中逐滴加入稀盐酸溶液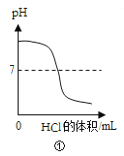
B.②将镁片和铁片(均足量)分别和等质量、等溶质质量分数的稀硫酸混合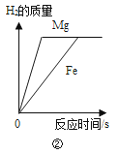
C.③是对于达到平衡状态的N2(g)+3H2(g)![]() 2NH3(g)反应,在t1时缩小容器体积
2NH3(g)反应,在t1时缩小容器体积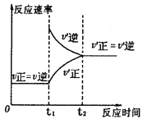
D.④是将pH=2的盐酸和醋酸分别加水稀释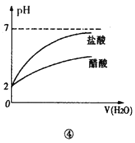
【答案】C
【解析】
A.向氢氧化钠溶液中逐滴滴加盐酸过程中,溶液pH逐渐减小,在滴定终点存在突变,随着反应的进行,溶液逐渐从碱性变为酸性,故A不符合题意;
B.镁和铁与稀硫酸反应均会生成氢气,金属活泼性:Mg>Fe,因此Mg与稀硫酸反应会先将硫酸消耗完,因氢气的产量与溶液中氢离子的量有关,二者反应过程中消耗的氢离子物质的量相同,二者反应结束后,氢气总量相同,故B不符合题意;
C.压缩体积的瞬间,体系中各物质的浓度均会增大,因此正逆反应速率均会增大,因此t1时刻正逆反应速率均会大于之前平衡状态的速率,压缩体积过程中,容器内压强增大,平衡将会正向移动,因此t1时刻v(正)>v(逆),最终达到平衡状态时的正逆反应速率均会大于之前平衡状态时的反应速率,故C符合题意;
D.在稀释过程中会促进醋酸分子的电离,因此稀释相同pH的盐酸和醋酸过程中,醋酸的pH变化较盐酸小,故D不符合题意;
故答案为:C。


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:
【题目】50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
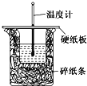
(1)从实验装置上看,图中尚缺少的一种玻璃用品是__________,烧杯间填满碎泡沫塑料的作用是________________________。
(2)大烧杯上如不盖硬纸板,则求得的中和热数值__(填“偏大”、“偏小”或“无影响”)。
(3)实验中若改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量______(填“相等”或“不相等”),所求中和热的数值______(填“相等”或“不相等”),理由是_______________________________。
(4)三次平行操作测得的数据中,起始时盐酸与烧碱溶液温度相同,而终止温度与起始温度之差(t2-t1)分别为2.3 ℃、2.4 ℃、2.9 ℃,则最终代入计算式的温度差的平均值为_____℃。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸汞和碘化钾溶液混合后会生成红色的碘化汞沉淀,为了探究硝酸汞和碘化钾溶液之间能否发生氧化还原反应,研究人员设计了如图的实验装置,结果电流计指针发生了偏转,下列分析正确的是( )

A.如图装置的电流方向是从C1到C2
B.C1是负极,发生的反应是2I-=I2+2e-
C.K+离子向C1电极流动
D.装置发生的总反应是Hg2++2I-=HgI2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】影响化学反应速率的因素很多,某课外兴趣小组用实验方法进行探究。
(1)取等物质的量浓度、等体积的H2O2溶液分别进行H2O2的分解实验,实验报告如下表所示(现象和结论略)。

①实验1、2研究的是__________对H2O2分解速率的影响。
②实验2、3的目的是_______________对H2O2分解速率的影响。
(2)查文献可知,Cu2+对H2O2分解也有催化作用,为比较Fe3+、Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:

①定性如图甲可通过观察_______,定性比较得出结论。有同学提出将CuSO4溶液改为CuCl2溶液更合理,其理由是_________。
②定量如图乙所示,实验时以收集到40 mL气体为准,忽略其他可能影响实验的因素,实验中需要测量的数据是__________。
(3)酸性高锰酸钾溶液和草酸溶液可发生反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,实验时发现开始反应速率较慢,溶液褪色不明显,但一段时间后突然褪色,反应速率明显加快。对此展开讨论:
①某同学认为KMnO4与H2C2O4的反应是______热反应,导致_______________;
②从影响化学反应速率的因素看,你认为还可能是________的影响。要证明你的猜想,实验方案是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氢氧化铁受热分解化学方程式:___。
(2)Al(OH)3与NaOH溶液反应的离子方程式:___。
(3)铁溶于盐酸的离子方程式:___。
(4)Na2O2与CO2反应的化学方程式:___。
(5)乙烯的结构式:___。
(6)乙烯的电子式:___。
(7)Na2O2的电子式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是8种有机化合物的转换关系:
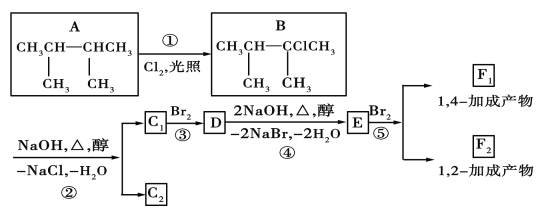
请回答下列问题:
(1)化合物E中含有的官能团的名称为___。
(2)上述框图中,①是___反应,③是___反应(填反应类型)。
(3)化合物E是重要的工业原料,写出由D生成E的化学方程式:___。
(4)C1的结构简式是___;F1的结构简式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A可由葡萄糖发酵得到,也可以从牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
称取A9.0g,升温使其汽化,测其密度是相同条件下H2的45倍 | 试通过计算填空: (1)A的相对分子质量为__。 |
将9.0gA在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g | (2)A的分子式为__。 |
另取A9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 | (3)用结构简式表示A中含有的官能团__、__。 |
A的核磁共振氢谱如图:
| (4)A中含有__种氢原子。 综上所述,A的结构简式为__。 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普罗帕酮,为广谱高效膜抑制性抗心律失常药。具有膜稳定作用及竞争性β受体阻滞作用。能降低心肌兴奋性,延长动作电位时程及有效不应期,延长传导。化合物I是合成普罗帕酮的前驱体,其合成路线如图:
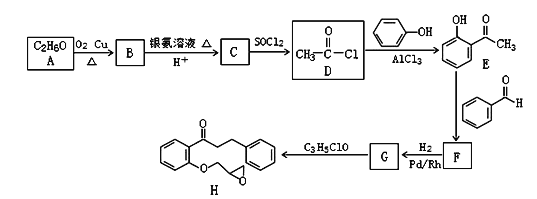
已知:CH3COCH3+CH3CHO![]() CH3COCH=CHCH3+H2O
CH3COCH=CHCH3+H2O
回答下列问题:
(1)H的分子式为_____________;化合物E中含有的官能团名称是_________。
(2)G生成H的反应类型是______。
(3)F的结构简式为_____。
(4)B与银氨溶液反应的化学方程式为__________。
(5)芳香族化合物M与E互为同分异构体,M中除苯环外,不含其他环状结构,且1molM能与2molNaOH反应,则M的结构共有___种,其中能发生银镜反应且核磁共振氢谱上显示4组峰的M的结构简式为:_______ 。
(6)参照上述合成路线,以2-丙醇和苯甲醛为原料(无机试剂任选),设计制备![]() 的合成路线:____。
的合成路线:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2O是重要的催化剂和化工原料,工业上制备Cu2O的主要反应如下:
①C(s)+CO2(g)2CO(g) ΔH=+172.5 kJ·mol-1
②CO(g)+2CuO(s) Cu2O(s)+CO2(g) ΔH=-138.0 kJ·mol-1
(1)C与CuO反应生成Cu2O和CO的热化学方程式为_______。
(2)一定温度下,向5L恒容密闭容器中加入1molCO和2 molCuO,发生反应②,5 min时达到平衡,测得容器中CuO的物质的量为0.8mol。
①0~5 min内,用CO2表示的反应速率v(CO2)=____。
②CO的平衡转化率α=_______。
(3)向5L密闭容器中加入1molC和1molCO2,发生反应①,CO2、CO的平衡体积分数(φ)与温度(T)的关系如图所示:
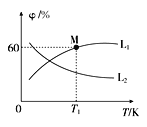
①能表示CO2的平衡体积分数与温度关系的曲线为____(填“L1”或“L2”),理由为_______。
②温度为T1时,该反应的平衡常数K=_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com