
 元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是( )
元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是( )| A、⑥、⑧、⑨对应单核离子的半径依次增大 |
| B、⑤的三种核素的化学性质不相同 |
| C、④的最高价氧化物对应的水化物能与其氢化物反应,生成离子化合物 |
| D、⑧、⑨两种元素的气态氢化物及其最高价氧化物的水化物均为强酸 |


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案科目:高中化学 来源: 题型:
| A、溶质的电离方程式为NaHCO3→Na++H++CO32- |
| B、25℃时,加水稀释后,n(H+)与n(OH-)的乘积变大 |
| C、离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
| D、温度升高,c(HCO3-)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、该反应的化学方程式:3X+2Y=2Z |
| B、若两容器均达到平衡时,两容器的体积V(I)<V(II),则容器II达到平衡所需时间小于t0 |
| C、若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固态或液态 |
| D、若达平衡后对容器II升高温度使其体积增大,说明Z发生的反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 符号 | 元素原子结构 |
X | 原子结构示意图为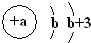 |
| Y | 最外层电子数是次外层电子数的2倍 |
Z | 原子核内含有12个中子,且其离子的结构示意图为  |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、乙醇分子中甲基的电子式为 |
| B、乙醇结构简式为:C2H6O |
C、乙醇分子中羟基电子式: |
D、乙醇分子的比例模型为: |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、适量Na2O2与CO2反应,生成1molO2时,转移的电子数为2NA |
| B、1mol甲醇中含有的C-H的数目为4NA |
| C、25℃时,pH=2的硫酸溶液中,含有的H+的数目为0.01NA |
| D、某密闭容器中有2molSO2和1molO2,在一定条件下充分反应,转移的电子数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


| O3 |
| Zn/H2O |
 +R3CHO
+R3CHO查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com