
【题目】短周期元素![]() 、
、![]() 、
、![]() 、
、![]() 的原子序数依次增大,
的原子序数依次增大,![]() 的原子在元素周期表中半径最小;
的原子在元素周期表中半径最小;![]() 的次外层电子数是其最外层电子数的
的次外层电子数是其最外层电子数的![]() ;
;![]() 的单质可与冷水剧烈反应,产生
的单质可与冷水剧烈反应,产生![]() 的单质;
的单质;![]() 与
与![]() 属于同一主族。下列叙述正确的是
属于同一主族。下列叙述正确的是
A.![]() 元素形成的简单离子与
元素形成的简单离子与![]() 元素形成的简单离子的核外电子总数相同
元素形成的简单离子的核外电子总数相同
B.单质的氧化性:![]()
C.化合物![]() 、
、![]() 、
、![]() 中化学键的类型完全相同
中化学键的类型完全相同
D.原子半径:![]()
【答案】A
【解析】
短周期元素![]() 、
、![]() 、
、![]() 、
、![]() 的原子序数依次增大,
的原子序数依次增大,![]() 的原子在元素周期表中半径最小,则
的原子在元素周期表中半径最小,则![]() 为
为![]() 元素;
元素;![]() 的次外层电子数是其最外层电子数的
的次外层电子数是其最外层电子数的![]() ,则
,则![]() 的次外层有2个电子,最外层电子数为6,
的次外层有2个电子,最外层电子数为6,![]() 为
为![]() 元素;
元素;![]() 的单质可与冷水剧烈反应,产生
的单质可与冷水剧烈反应,产生![]() 的单质,
的单质,![]() 为
为![]() 元素。
元素。
A.![]() 与
与![]() 属于同一主族,
属于同一主族,![]() 为
为![]() 元素。
元素。![]() 元素形成的简单离子与
元素形成的简单离子与![]() 元素形成的简单离子的核外电子总数均为10,A项正确;
元素形成的简单离子的核外电子总数均为10,A项正确;
B.非金属性越强,该元素单质的氧化性就越强,非金属性:![]() ,所以氧化性:
,所以氧化性:![]() ,B项错误;
,B项错误;
C.化合物![]() 是
是![]() ,只含共价键,
,只含共价键,![]() 是
是![]() ,只含有离子键,
,只含有离子键,![]() 是
是![]() ,只含离子键,C项错误;
,只含离子键,C项错误;
D.同一周期元素,从左到右,原子半径逐渐减小,不同周期元素,原子核外电子层数越多,原子半径越大,所以原子半径:![]() ,D项错误;
,D项错误;
答案选A。


 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组对一种废旧合金(含有Cu、Fe、Si等元素)进行分离、回收再利用,所设计工艺流程如图。
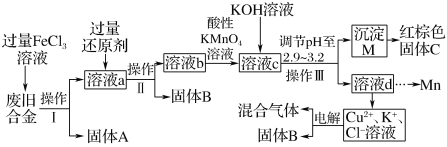
已知:298K时,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Mn(OH)2]=1.9×10-13
回答下列问题:
(1)操作Ⅰ、Ⅱ、Ⅲ为__,固体B为__(填化学式)。
(2)加入过量FeCl3溶液过程中与较不活泼的金属反应的离子方程式__。
(3)调节pH至2.9~3.2的目的是分离__(填离子符号)
(4)①向溶液b中加入酸性KMnO4溶液发生反应的离子方程式为__。
②若用amol/LKMnO4溶液处理溶液b,当恰好反应时消耗KMnO4溶液VmL,所得红棕色固体C的物质的量为__(用含a、V的代数式表示)
(5)用惰性电极电解时阳极产生标准状况下的气体6.72L,阴极得到的电子数为0.8NA,则生成氧气的物质的量为__mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中,有关微粒的物质的量浓度关系不正确的是
A.0.1mol/L的NaA溶液和0.1mol/L的HA溶液等体积混合pH=4.75,则溶液:c(HA)+c(H+)=c(OH-)+c(A-)
B.0.1mol·L-1(NH4)2Fe(SO4)2溶液:c(NH4+)+2c(Fe2+)+c(H+)=2c(SO42-)+c(OH-)
C.分别用pH=2和pH=3的CH3COOH溶液中和含等物质的量NaOH的溶液,消耗CH3COOH溶液的体积分别为Va和Vb,则10Va<Vb
D.等物质的量浓度的①NH4Cl溶液②(NH4)2SO4溶液③NH4HSO4溶液④(NH4)2CO3溶液⑤NH4HCO3中NH4+浓度的大小关系是②>④>③>①>⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]端炔烃在催化剂存在下可发生偶联反应,称为Glaser反应。
2R—C≡C—H![]() R—C≡C—C≡C—R+H2
R—C≡C—C≡C—R+H2
该反应在研究新型发光材料、超分子化学等方面具有重要价值。下面是利用Glaser反应制备化合物E的一种合成路线:

回答下列问题:
(1)B的结构简式为______,D 的化学名称为______。
(2)①和③的反应类型分别为______、______。
(3)E的结构简式为______。用1 mol E合成1,4二苯基丁烷,理论上需要消耗氢气_______mol。
(4)化合物(![]() )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为_____________________________________。
)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为_____________________________________。
(5)芳香化合物F是C的同分异构体,其分子中只有两种不同化学环境的氢,数目比为3:1,写出其中3种的结构简式_______________________________。
(6)写出用2苯基乙醇为原料(其他无机试剂任选)制备化合物D的合成路线___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84消毒液”因1984年北京某医院研制使用而得名,在日常生活中使用广泛,其有效成分是NaClO。某小组在实验室制备NaClO溶液,并进行性质探究和成分测定。
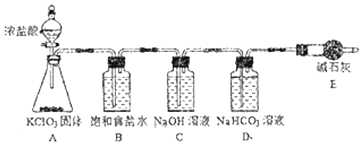
(1)该小组按如图装置进行实验,反应一段时间后,分别取B、C、D瓶的溶液进行实验,实验现象如表。(已知饱和NaClO溶液pH为11)
实验步骤 | 实验现象 | ||
B瓶 | C瓶 | D瓶 | |
实验1:取样,滴加紫色石蕊溶液 | 变红,缓慢褪色 | 变红,缓慢褪色 | 立即褪色 |
实验2:取样,测定溶液的pH | 3 | 12 | 7 |
①装置A中反应的化学方程式为____。
②B瓶溶液中H+的主要来源是____。
③C瓶溶液的溶质是___(填化学式)。
④结合平衡移动原理解释D瓶溶液中石蕊立即褪色的原因____。
(2)测定C瓶溶液中NaClO含量(单位:gL-1)的实验步骤如下:
Ⅰ.取C瓶溶液20mL于锥形瓶,加足量盐酸酸化,迅速加入过量KI溶液,盖紧瓶塞并在暗处充分反应。
Ⅱ.用0.1000molL-1Na2S2O3标准溶液滴定锥形瓶中的溶液,指示剂显示终点时共用去20.00mLNa2S2O3溶液。(I2+2S2O32-=2I-+S4O62-)
①NaClO的电子式为____。
②步骤Ⅰ总反应的离子方程式为____。
③C瓶溶液中NaClO的含量为____gL-1。(保留1位小数,NaClO式量为74.5)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl晶体呈白色,熔点为430℃,沸点为1490℃,见光分解,露置于潮湿空气中易被氧化,难溶于水、稀盐酸、乙醇,易溶于浓盐酸生成H3CuCl4,反应的化学方程式为CuCl(s)+3HCl(aq)H3CuCl4(aq).
(1)实验室用如图1所示装置制取CuCl,反应原理为:
2Cu2++SO2+8Cl﹣+2H2O═2CuCl43﹣+SO![]() +4H+
+4H+
CuCl43﹣(aq)CuCl(s)+3Cl﹣(aq)

①装置C的作用是_____.
②装置B中反应结束后,取出混合物进行如图所示操作,得到CuCl晶体.
混合物![]()
![]()
![]()
![]()
![]() CuCl晶体
CuCl晶体
操作ⅱ的主要目的是_____
操作ⅳ中最好选用的试剂是_____.
③实验室保存新制CuCl晶体的方法是_____.
④欲提纯某混有铜粉的CuCl晶体,请简述实验方案:_____.
(2)某同学利用如图2所示装置,测定高炉煤气中CO、CO2、N2和O2的百分组成.
已知:
i.CuCl的盐酸溶液能吸收CO形成Cu(CO)ClH2O.
ii.保险粉(Na2S2O4)和KOH的混合溶液能吸收氧气.
①D、F洗气瓶中宜盛放的试剂分别是_____、_____.
②写出保险粉和KOH的混合溶液吸收O2的离子方程式:_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2H2O(l)=2H2(g)+O2(g) ΔH=+571.0kJ/mol。以太阳能为热源分解Fe3O4,经热化学铁氧化合物循环分解水制H2的过程如下:
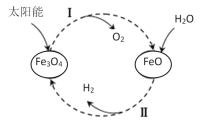
过程Ⅰ:2Fe3O4(s)=6FeO(s)+O2(g) ΔH=+313.2kJ/mol
过程Ⅱ:……
下列说法不正确的是( )
A.过程Ⅰ中每消耗232gFe3O4转移2mol电子
B.过程Ⅱ热化学方程式为:3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) ΔH=-128.9kJ/mol
C.过程Ⅰ、Ⅱ中能量转化的形式依次是:太阳能→化学能→热能
D.铁氧化合物循环制H2具有成本低、产物易分离等优点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是
A.有氧气参与的反应都是放热反应
B.热化学方程式既表示能量的变化,又表示物质的变化
C.若2CO2(g)![]() 2CO(g)+O2(g)△H=+566kJ·mol-1,则CO的燃烧热△H=-566 kJ·mol-1
2CO(g)+O2(g)△H=+566kJ·mol-1,则CO的燃烧热△H=-566 kJ·mol-1
D.放热反应理论上都可以设计为原电池,将化学能转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学上以12C作为确定原子量的标准。若把12C的原子量定为24,并规定把24g12C所含碳原子数定为阿伏伽德罗常数,用NA表示,则下列推论中正确的是( )
A.12g碳单质完全燃烧需要体积约为11.2L(标准状况)的氧气
B.44gCO2和28gCO含有相同数目的分子
C.NA个氧分子和1mol氢分子的质量之比为8:1
D.氧气的摩尔质量为64g/mol,所以32g氧气所含分子数目为3.01×1023个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com