
【题目】SO2是一种大气污染物,可用NAOH溶液除去,下列有关解释的方程式不合理的是
A.SO2在大气中能最终生成H2SO4:2SO2+O2+2H2O=4H++2SO42-
B.少量SO2与NAOH溶液反应的离子方程式是:SO2+OH-=HSO3-
C.NAOH溶液缓慢吸收过量SO2的过程中有:SO2+SO32-+H2O=2HSO3-
D.n(SO2):n(NAOH)=1:2时,溶液pH>7:SO32-+H2O![]() HSO3-+OH-
HSO3-+OH-
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】将0.1mol/L的K2SO4溶液、0.2mol/L的Al2(SO4)3溶液和纯水混合,要使混合溶液中K+、Al3+、SO42-的浓度分别为0.1mol/L、0.1mol/L和0.2mol/L,则所取K2SO4溶液、Al2(SO4)3溶液、纯水三者体积比是(忽略混合后体积变化)
A.1:1:1 B.2:1:1 C.1:1:2 D.2:1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】牛通过吃草,从草中获得化合物和化学元素,那么,牛和草在化学元素的种类以及相同化学元素的含量上分别是
A. 种类差异很大,含量上大体相同
B. 种类和含量差异都很大
C. 种类和含量都大体相同
D. 种类大体相同,含量差异较大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 在船体上镶嵌铜块,可以减缓船体被海水腐蚀的速率
B. 粗铜精炼时,电解液中的c(Cu2+)基本保持不变
C. 铁钉在氯化铵溶液中慢慢溶解,属于吸氧腐蚀
D. 在滴定实验中,可以用量筒量取21.00 mL的NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法不正确的是 ( )
A.乙烯可作水果的催熟剂
B.硅胶可作袋装食品的干燥剂
C.福尔马林可作食品的保鲜剂
D.氢氧化铝可作胃酸的中和剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S水溶液中存在电离平衡H2S![]() H++HS-和HS-
H++HS-和HS-![]() H++S2-。若向H2S溶液中
H++S2-。若向H2S溶液中
A. 加水,平衡向右移动,溶液中氢离子浓度增大
B. 通入过量SO2气体,平衡向左移动,溶液pH增大
C. 滴加新制氯水,平衡向左移动,溶液pH减小
D. 加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源的开发利用与人类社会的可持续性发展息息相关。
I.已知:Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)△H1=akJ·mol-1
CO(g)+1/2O2(g)=CO2(g)△H2=bkJ·mol-1
4Fe(s)+3O2(g)=2Fe2O3(s)△H3=ckJ·mol-1
则C的燃烧热________kJ·mol-1
Ⅱ.(1)依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是(填序号)。
A.C(s)+CO2(g)=2CO(g)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1)
C.2H2O(l)=2H2(g)+O2(g)
D.2CO(g)+O2(g)=2CO2(g)
若以熔融的K2C03与C02为反应的环境,依据所选反应设计成一个原电池,请写出该原电池的负极反应:。
(2)某实验小组模拟工业合成氨反应N2(g)+3H2(g)![]() 2NH3(g)△H=-92.4kJ·mol-1,开始他们将N2和H2混合气体20mol(体积比1:1)充入5L合成塔中。反应前压强为P。,反应过程中压强用P表示,反应过程中P/P。与时间t的关系如下图所示。请回答下列问题:
2NH3(g)△H=-92.4kJ·mol-1,开始他们将N2和H2混合气体20mol(体积比1:1)充入5L合成塔中。反应前压强为P。,反应过程中压强用P表示,反应过程中P/P。与时间t的关系如下图所示。请回答下列问题:
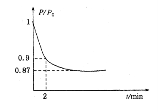
①反应达平衡的标志是(填字母代号)。
A.压强保持不变
B.气体密度保持不变
C.NH3的生成速率是N2的生成速率的2倍
②2min时,以C(N2)变化表示的平均反应速率为。
③若提高N2的转化率可采取的措施有。
A.向体系中按体积比1:1再充入N2和H2
B.分离出NH3
C.升高温度
D.充入He气使压强增大E.加入一定量的N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是
A.常温下,100g 46%乙醇水溶液中含有H原子数为12 NA
B.23g NA与足量O2反应,生成NA2O 和NA2O2 的混合物,转移的电子数为 NA
C.标准状况下,2.24 LCCl4 含有的共价键数为0.4 NA
D.1 molN2与4molH2反应生成的NH3分子数小于2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表中的一部分,
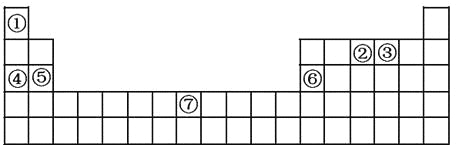
回答下列问题:
(1)画出③元素的原子结构示意图 ;在④⑤⑥三种元素中,原子半径最大的是 (用元素符号表示);⑦元素在周期表中的位置是 。
(2)④的单质在③的单质中燃烧生成甲,甲中化学键的类型为 。
(3)写出⑥的最高价氧化物与④的最高价氧化物对应水化物反应的离子方程式 。
(4)②的最简单气态氢化物与其最高价含氧酸可发生化合反应生成乙,用离子方程式表示乙的水溶液显酸性的原因 。
(5)丙是⑤的最高价氧化物对应的水化物,难溶于水。在298K时,丙的Ksp=5.6×10—12,则pH=13.0的丙的饱和溶液中,⑤离子的物质的量浓度为 。
(6)向含元素⑦的某硫酸盐(丁)溶液中加入足量的浓NaOH溶液,生成无色有刺激性气味的气体,同时产生白色沉淀,很快变成灰绿色,最后变成红褐色。写出丁的化学式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com