
【题目】A、B、C、D、E、F均为短周期主族元素,且原子序数依次增大,A是原子半径最小的元素,B的最高价氧化物的水化物可与其氢化物反应形成离子化合物甲;A与D可以按照原子个数比4:1形成化合物乙,且乙分子中含有18个电子,E与B同主族,C的阳离子与F的阴离子相差一个电子层,且可形成阳离子、阴离子个数比为2:1的离子化合物丙.
(1)B的气态氢化物的电子式为_____________,请用电子式表示A与C形成化合物的过程____________。
(2)E在周期表中的位置为______________________。
(3)下列说法正确的有_________。
①化合物乙分子中只含有极性共价键
②化合物甲和化合物丙都含有离子键和共价键
③B、E分别与A形成的简单化合物中,B的更稳定
④C、D、E、F原子半径由大到小的顺序为C>D>E>F
(4)写出由以上元素构成的10电子分子与18电子分子按物质的量之比1:1反应生成盐的化学方程式_____。
【答案】(1)![]() ;
;![]() ;
;
(2)第三周期第VA族;
(3)①③④;(4)NH3+H2S=NH4HS。
【解析】
试题A、B、C、D、E、F均为短周期主族元素,且原子序数依次增大,A是原子半径最小的元素,则A是H元素;B的最高价氧化物的水化物可与其氢化物反应形成离子化合物甲,则B是N元素,甲的NH4NO3;A与D可以按照原子个数比4:1形成化合物乙,则D是Si元素,乙是SiH4,且乙分子中含有18个电子,E与B同主族,则E是P元素;C的阳离子与F的阴离子相差一个电子层,且可形成阳离子、阴离子个数比为2:1的离子化合物丙,则C是Na元素,F是S元素,丙是Na2S。(1)B的气态氢化物的电子式为![]() ;H与Na通过离子键结合形成离子化合物NaH,其电子式表示的形成过程是:
;H与Na通过离子键结合形成离子化合物NaH,其电子式表示的形成过程是:![]() ;(2)E是P元素,在周期表中的位置为第三周期第VA族;(3)①化合物乙是SiH4,分子中只含有极性共价键Si—H键,正确;②化合物甲是NH4NO3,含有离子键和共价键;化合物丙是Na2S。只含有离子键,错误;③B、E的非金属性B>E,所以二者分别与A形成的简单化合物中,B的更稳定,正确;④C、D、E、F他同一周期的元素,由于原子序数越大,原子半径越小,所以原子半径由大到小的顺序为C>D>E>F,正确;(4)由以上元素构成的10电子分子NH3与18电子分子H2S按物质的量之比1:1反应生成盐的化学方程式是NH3+H2S=NH4HS。
;(2)E是P元素,在周期表中的位置为第三周期第VA族;(3)①化合物乙是SiH4,分子中只含有极性共价键Si—H键,正确;②化合物甲是NH4NO3,含有离子键和共价键;化合物丙是Na2S。只含有离子键,错误;③B、E的非金属性B>E,所以二者分别与A形成的简单化合物中,B的更稳定,正确;④C、D、E、F他同一周期的元素,由于原子序数越大,原子半径越小,所以原子半径由大到小的顺序为C>D>E>F,正确;(4)由以上元素构成的10电子分子NH3与18电子分子H2S按物质的量之比1:1反应生成盐的化学方程式是NH3+H2S=NH4HS。


科目:高中化学 来源: 题型:
【题目】某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是

A. 正极反应为AgCl +e-=Ag +Cl-
B. 放电时,交换膜右侧溶液中有大量白色沉淀生成
C. 若用NaCl溶液代替盐酸,则电池总反应随之改变
D. 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z、R的原子序数依次增大,A、B、C、D、E、F均是由上述元素组成的中学化学常见物质,其中A是四元化合物,C是能使湿润红色石蕊试纸变蓝的气体,D具有漂白性,E是单质。各物质之间存在如图转化关系(部分产物未标出)。下列说法不正确的是( )

A. 简单离子半径大小关系:Y>Z>RB. 简单阴离子的还原性:W>Y>Z
C. 氢化物的沸点:Z>Y>XD. C和E反应生成F是工业制硝酸的重要反应之一
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学欲探究NH3的催化氧化反应,按下图装置进行实验。A、B装置可选用的药品:浓氨水、H2O2溶液、蒸馏水、NaOH固体、MnO2。
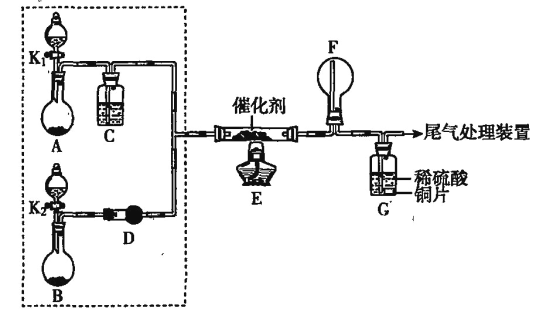
(1)NH3催化氧化的化学方程式是__________。
(2)甲、乙两同学分别按上图装置进行实验。一段时间后,装置G中的溶液都变成蓝色。
①甲观察到装置F中有红棕色气体,生成红棕色气体的化学方程式是__________。
②乙观察到装置F中只有白烟生成,白烟的成分是__________(填化学式)。
③用离子方程式解释装置G中溶液变成蓝色的原因:__________。
(3)为帮助乙实现在装置F中也观察到红棕色气体,可在原实验的基础上进行改进:
①甲认为可调节K1和K2控制A、B装置中的产气量,应__________(填“增加”或“减少”)装置A中的产气量,或__________(填“增加”或“减少”)装置B中的产气量。
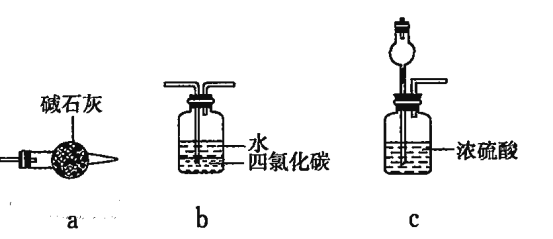
②乙认为可在装置E、F间增加置,该装置可以是__________(填字母序号)。
(4)为实现该反应,也可用下图所示的装置替换题.给装置中虚线框部分,
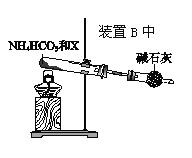
化合物X为__________。NH4HCO3的作用是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在元素周期表中,非金属元素集中于右上角的位置,它们虽然种类少,但其用途却不容小觑。
(1)元素周期表的非金属元素中,属于主族元素的共有________种。
(2)红磷是巨型共价分子、无定型结构。能证明红磷是非晶体的最可靠方法是________。
A.质谱 B.原子发射光谱 C.核磁共振谱 D.X射线衍射
(3)成语“信口雕黄”中的雌黄分子式为As2S3,分子结构如右图。
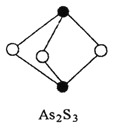
其分子中S原子的杂化方式为________。雌黄和SnCl2在盐酸中反应转化为雄黄(As4S4)和SnCl4并放出H2S气体,写出该反应的化学方程式______。
(4)已知pKa=-lgKa。
①有机酸的酸性强弱受邻近碳上取代原子的影响,如酸性:BrCH2COOH>CH3COOH。据此推测,pKa:ClCH2COOH______FCH2COOH(填“>”、“<”、“=”)。
②硼酸(H3BO3)是一元酸,它在水中表现出来的弱酸性,并不是自身电离出H+所致,而是H3BO3与水电离出的OH-结合生成一个酸根离子,请写出该酸根离子的结构简式: ________(若存在配位键,请用箭头标出)。
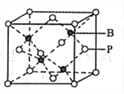
(5)磷化硼的晶胞模型如右图所示,晶胞参数为apm,已知B、P的原子半径分别表示为rBpm、rPpm。该晶胞中磷原子的配位数为________,晶体中原子的空间利用率为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子,在溶液中能大量共存的是( )
A. Na+、NH4+、OH-、NO3- B. Fe2+、H+、NO3-、Cl-
C. K+、Ba2+、SO42-、Cl- D. Mg2+、Na+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中和热的测定实验中,可能用到下列仪器:
①托盘天平 ②量筒 ③烧杯 ④温度计 ⑤小试管 ⑥酒精灯。
其中应使用仪器的正确组合是
A. ①②⑤B. ②③④C. ②③⑥D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,按熔点由低到高的顺序排列正确的是( )
①O2、I2、Hg ②CO、Al、SiO2 ③Na、K、Rb ④Na、Mg、Al
A. ①③
B. ①④
C. ②③
D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烯是无色有毒,带有辛辣气味的易燃液体,结构如右图所示。人体吸入过多的苯乙烯蒸气时会引起中毒,在空气中的允许浓度在1×10-4 kgm-3以下。下列关于苯乙烯的性质推断中正确的是( )

A. 它的分子式是C8H8
B. 它能使溴的四氯化碳溶液褪色,不能使酸性高锰酸钾溶液褪色
C. 它易溶于水,也易溶于有机溶剂
D. 苯乙烯中所有的原子不可能共平面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com