
【题目】在元素周期表中,非金属元素集中于右上角的位置,它们虽然种类少,但其用途却不容小觑。
(1)元素周期表的非金属元素中,属于主族元素的共有________种。
(2)红磷是巨型共价分子、无定型结构。能证明红磷是非晶体的最可靠方法是________。
A.质谱 B.原子发射光谱 C.核磁共振谱 D.X射线衍射
(3)成语“信口雕黄”中的雌黄分子式为As2S3,分子结构如右图。
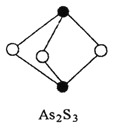
其分子中S原子的杂化方式为________。雌黄和SnCl2在盐酸中反应转化为雄黄(As4S4)和SnCl4并放出H2S气体,写出该反应的化学方程式______。
(4)已知pKa=-lgKa。
①有机酸的酸性强弱受邻近碳上取代原子的影响,如酸性:BrCH2COOH>CH3COOH。据此推测,pKa:ClCH2COOH______FCH2COOH(填“>”、“<”、“=”)。
②硼酸(H3BO3)是一元酸,它在水中表现出来的弱酸性,并不是自身电离出H+所致,而是H3BO3与水电离出的OH-结合生成一个酸根离子,请写出该酸根离子的结构简式: ________(若存在配位键,请用箭头标出)。
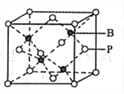
(5)磷化硼的晶胞模型如右图所示,晶胞参数为apm,已知B、P的原子半径分别表示为rBpm、rPpm。该晶胞中磷原子的配位数为________,晶体中原子的空间利用率为______。
【答案】 16 D sp3杂化 2As2S3+2SnCl2+4HCl=As4S4+2SnCl4+2H2S↑ > ![]() 4
4 ![]()
【解析】(1)元素周期表中,惰性元素除外,第一周期有一种非金属,第二周期有7-2=5种、第三周期有7-3=4种、第四周期有7-4=3种、第五周期有7-5=2种,第六周期有7-6=1种,第七周期开始没有非金属元素,故共有1+5+4+3+2+1=16种;(2)红磷是巨型共价分子、无定型结构。能证明红磷是非晶体的最可靠方法是X射线衍射,答案选D;(3)As2S3中S原子杂化方式为sp3杂化;雌黄和SnCl2在盐酸中反应转化为雄黄(As4S4)和SnCl4并放出H2S气体,该反应的化学方程式为2As2S3+2SnCl2+4HCl=As4S4+2SnCl4+2H2S↑;(4) ①有机酸的酸性强弱受邻近碳上取代原子的影响,如酸性:BrCH2COOH>CH3COOH。因HF为弱酸,故电离出氟离子更难,据此推测,pKa:ClCH2COOH>FCH2COOH;②硼酸(H3BO3)是一元酸,它在水中表现出来的弱酸性,并不是自身电离出H+所致,而是H3BO3与水电离出的OH-结合生成一个酸根离子,该酸根离子的结构简式为![]() ;(5)根据晶胞模型所示,晶胞中磷原子的配位数为4;根据均摊法计算,每个晶胞中含有8
;(5)根据晶胞模型所示,晶胞中磷原子的配位数为4;根据均摊法计算,每个晶胞中含有8![]() 个P,4个B,晶胞的体积为
个P,4个B,晶胞的体积为![]() ,晶胞所占体积为
,晶胞所占体积为![]() ,晶体中原子的空间利用率为
,晶体中原子的空间利用率为![]() 。
。


科目:高中化学 来源: 题型:
【题目】已知X、Y和Z三种元素的原子序数之和等于48。X的一种1∶1型氢化物分子中既有σ键又有π键。Z是金属元素,Z的单质和化合物广泛的用途。已知Z的核电荷数小于28,且次外层有2个未成对电子。工业上利用ZO2和碳酸钡在熔融状态下制取化合物M(M可看做一种含氧酸盐)。M有显著的“压电性能”,应用于超声波的发生装置。经X射线分析,M晶体的最小重复单元为正方体(如图),边长为4.03×10-10 m,顶点位置为Z4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占。
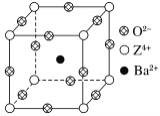
(1) Y在周期表中位于______________;Z4+的核外电子排布式为___________________。
(2)X的该种氢化物分子构型为________,X在该氢化物中以_______方式杂化。X和Y形成的化合物的熔点应该_______(填“高于”或“低于”)X氢化物的熔点。
(3)①制备M的化学方程式是_____________。
②在M晶体中,若将Z4+置于正方体的体心,Ba2+置于正方体的顶点,则O2-处于正方体的________。
③在M晶体中,Z4+的氧配位数为________。
④已知O2-半径为1.40×10-10 m,则Z4+半径为____ m。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向下列溶液中通入适量SO2,能产生白色沉淀的是( )
A. BaCl2溶液 B. NaOH溶液 C. H2S饱和溶液 D. 酸化的Ba(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中常用到0.1 mol/L的NaOH溶液,其中的“mol/L”对应的物理量是( )
A. 体积B. 物质的量浓度C. 摩尔质量D. 质量分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F均为短周期主族元素,且原子序数依次增大,A是原子半径最小的元素,B的最高价氧化物的水化物可与其氢化物反应形成离子化合物甲;A与D可以按照原子个数比4:1形成化合物乙,且乙分子中含有18个电子,E与B同主族,C的阳离子与F的阴离子相差一个电子层,且可形成阳离子、阴离子个数比为2:1的离子化合物丙.
(1)B的气态氢化物的电子式为_____________,请用电子式表示A与C形成化合物的过程____________。
(2)E在周期表中的位置为______________________。
(3)下列说法正确的有_________。
①化合物乙分子中只含有极性共价键
②化合物甲和化合物丙都含有离子键和共价键
③B、E分别与A形成的简单化合物中,B的更稳定
④C、D、E、F原子半径由大到小的顺序为C>D>E>F
(4)写出由以上元素构成的10电子分子与18电子分子按物质的量之比1:1反应生成盐的化学方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种有机光电材料中间体。实验室由芳香族化合物A制备H的一种合成路线如下:
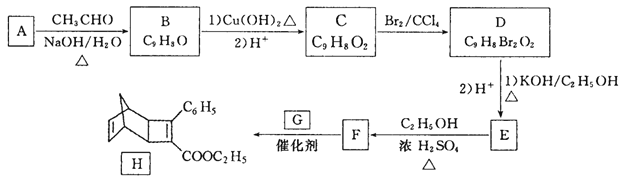
已知:
①RCHO+CH3CHO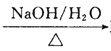 RCH=CHCHO+H2O
RCH=CHCHO+H2O
②
回答下列问题:
(1)1molA完全加成时最多可消耗H2______mol;E的结构简式是_______ 。
(2)F分子中包含的官能团名称是______;D→E的反应类型是______ 。
(3)写出由F生成H的化学方程式_______ 。
(4)芳香族化合物X是F的同分异构体,X能与饱和碳酸氢钠容液反应放出CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6:2:1:1,则符合要求的X的结构简式有______种。
(5)结合本题信息,仿照上述合成路线,设计由![]() 和丙醛合成
和丙醛合成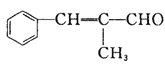 的流程图:______(无机试剂任选)。
的流程图:______(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度相同、浓度均为0.2mol/L的①(NH4)2SO4、②NaNO3、③NH4HSO4、④NH4NO3、![]() 、⑥CH3COONa溶液,它们的pH值由小到大的排列顺序是( )
、⑥CH3COONa溶液,它们的pH值由小到大的排列顺序是( )
A. ③①④②⑥⑤
B. ①③⑥④②⑤
C. ③②①⑥④⑤
D. ⑤⑥②④①③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com