
【题目】下列各组离子,在溶液中能大量共存的是( )
A. Na+、NH4+、OH-、NO3- B. Fe2+、H+、NO3-、Cl-
C. K+、Ba2+、SO42-、Cl- D. Mg2+、Na+、Cl-、SO42-
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】工业废弃物的资源化回收再利用,可以更大限度的发挥原材料的价值,以下是工业生产纳米磁性氧化铁的流程,下列说法不正确的是

A. 用Na2CO3溶液浸泡是为了除去废铁屑表面的铁锈
B. 加适量的H2O2是为了将部分Fe2+氧化为Fe3+
C. 若生产中不通入N2,暴露在空气中生产,将不能得到高纯度产品
D. 溶液A中Fe2+和Fe3+的浓度比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一容积不变的密闭容器中充入一定量A和B,发生如下反应:xA(g)+2B(s) ![]() yC(g) ΔH<0,一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:
yC(g) ΔH<0,一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:
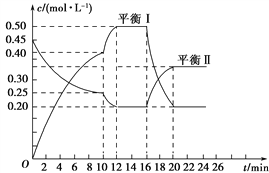
(1)用A的浓度变化表示该反应在0~10 min内的平均反应速率v(A)=______________________。
(2)根据图示可确定x∶y=________。
(3)0~10 min容器内压强________(填“变大”、“不变”或“变小”)。
(4)推测第10 min引起曲线变化的反应条件可能是______________________;第16min引起曲线变化的反应条件可能是________________________。
①减压 ②增大A的浓度 ③增大C的量 ④升温⑤降温 ⑥加催化剂
(5)若平衡Ⅰ的平衡常数为K1,平衡Ⅱ平衡常数为K2,则K1________K2(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F均为短周期主族元素,且原子序数依次增大,A是原子半径最小的元素,B的最高价氧化物的水化物可与其氢化物反应形成离子化合物甲;A与D可以按照原子个数比4:1形成化合物乙,且乙分子中含有18个电子,E与B同主族,C的阳离子与F的阴离子相差一个电子层,且可形成阳离子、阴离子个数比为2:1的离子化合物丙.
(1)B的气态氢化物的电子式为_____________,请用电子式表示A与C形成化合物的过程____________。
(2)E在周期表中的位置为______________________。
(3)下列说法正确的有_________。
①化合物乙分子中只含有极性共价键
②化合物甲和化合物丙都含有离子键和共价键
③B、E分别与A形成的简单化合物中,B的更稳定
④C、D、E、F原子半径由大到小的顺序为C>D>E>F
(4)写出由以上元素构成的10电子分子与18电子分子按物质的量之比1:1反应生成盐的化学方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】古瓷中所用颜料的成分一直是个谜,近年来科学家才得知大多为硅酸盐,如蓝紫色的硅酸铜钡(BaCuSi2Ox,铜为+2价),下列关于硅酸铜钡的说法不正确的是( )
A.可用氧化物形式表示为BaO·CuO·2SiO2
B.性质稳定,不易脱色
C.易溶解于强酸和强碱
D.x等于6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下可逆反应:A(s)+2B(g)![]() 2C(g)+D(g);△H>0。现将1molA和2molB加入甲容器中,将4 molC和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是
2C(g)+D(g);△H>0。现将1molA和2molB加入甲容器中,将4 molC和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是
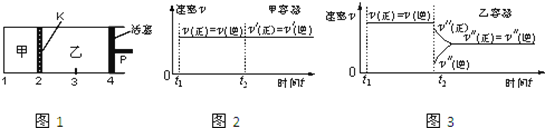
A. 保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍
B. 保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增加
C. 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍
D. 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国的酒文化历史悠久,古代文献中就记我了烧酒制备工艺“凡酸坏之酒,皆可蒸烧”,“以烧酒复烧二次,价值数倍也”。这里用到的分离方法可以用于分离下列哪组物质
A. 碳酸钠和碳酸氢钠 B. 四氯化碳和水 C. 乙醇和水 D. 氯化钠和硝酸钾
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com