
【题目】某化学兴趣小组的同学设计了如图所示的装置,完成下列问题:
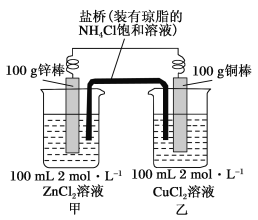
(1)反应过程中,_____棒质量减少,当一电极质量增加2 g,另一电极减轻的质量_____(填“大于”、“小于”或“等于”)2g,正极的电极反应为_______。
(2)盐桥的作用是向甲、乙两烧杯中提供NH![]() 和Cl-,使两烧杯溶液中保持电荷守恒。
和Cl-,使两烧杯溶液中保持电荷守恒。
①反应过程中Cl-将进入______(填“甲”或“乙”)烧杯。
②当外电路中转移0.2 mol电子时,乙烧杯中浓度最大的阳离子是______。
【答案】锌 大于 Cu2++2e-=Cu 甲 NH4+
【解析】
锌比铜活泼,锌为负极,发生氧化反应,电极方程式为Zn-2e-=Zn2+,铜为正极,发生还原反应,电极方程式为Cu2++2e-=Cu,结合电极方程式解答该题;
(1) 锌比铜活泼,锌为负极,铜为正极,铜电极析出铜;
(2)盐桥的作用是向甲、乙两烧杯中提供NH![]() 和Cl-,使两烧杯溶液中保持电荷守恒。
和Cl-,使两烧杯溶液中保持电荷守恒。
①原电池中阴离子移向负极,阳离子移向正极;
②乙烧杯中铜离子析出,电荷守恒计算铵根离子浓度。
锌比铜活泼,锌为负极,发生氧化反应,电极方程式为Zn-2e-=Zn2+,铜为正极,发生还原反应,电极方程式为Cu2++2e-=Cu;
(1)反应过程中,锌棒是负极,发生氧化反应,质量减小,而铜棒是正极,发生还原反应,电极反应式为Cu2++2e-=Cu,则正极上质量增重,当正极质量增加2g时,转移电子的物质的量为![]() ×2mol=
×2mol=![]() mol,此时负极质量减少
mol,此时负极质量减少![]() mol×65g/mol×
mol×65g/mol×![]() >2g;
>2g;
(2) ①反应过程中,盐桥中的Cl-移向负极锌,Cl-进入甲杯;
②当外电路中转移0.2mol电子时,Cu2++2e-=Cu,铜离子减少0.1mol,电荷减少0.2mol,溶液中进入NH4+0.2mol,乙烧杯中浓度最大的阳离子是NH4+,其浓度=![]() =2mol/L。
=2mol/L。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列关于热化学方程式的说法正确的是
A. H2的燃烧热为285.8 kJ·mol1,则表示H2燃烧的热化学方程式可表示为:H2(g)+ ![]() O2
O2![]() H2O(g) ΔH=285.8 kJ·mol1
H2O(g) ΔH=285.8 kJ·mol1
B. 中和热为57.3 kJ·mol1,则NaOH与醋酸反应的中和热可以表示如下:NaOH(aq)+CH3COOH(aq)![]() CH3COONa(aq)+H2O(l) ΔH=57.3 kJ·mol1
CH3COONa(aq)+H2O(l) ΔH=57.3 kJ·mol1
C. 已知:C(s,金刚石)+O2(g)![]() CO2(g) ΔH=395.4 kJ·mol1,C(s,石墨)+O2(g)
CO2(g) ΔH=395.4 kJ·mol1,C(s,石墨)+O2(g)![]() CO2(g) ΔH=393.5 kJ·mol1,则C(s,金刚石)
CO2(g) ΔH=393.5 kJ·mol1,则C(s,金刚石)![]() C(s,石墨)ΔH=1.9 kJ·mol1
C(s,石墨)ΔH=1.9 kJ·mol1
D. 已知1 mol CH4完全燃烧生成CO2和液态水放出890.4 kJ的热量,则该反应中转移1 mol电子时放出的热量为222.6 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细磷化工产品,属于一元弱酸,具有较强的还原性。下列说法正确的是( )
A. 用惰性电极电解NaH2PO2溶液,其阳极反应式为2H2O+4e-=O2↑+4H+
B. 将H3PO2溶液加入到酸性高锰酸钾溶液中,H3PO2的还原产物可能为H3PO4
C. H3PO2与过量NaOH溶液反应的离子方程式为H3PO2+3OH-= PO23-+3H2O
D. H3PO2溶于水的电离方程式为H3PO2![]() H++H2PO2-
H++H2PO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物如NH3及铵盐、N2H4、N2O4等在中学化学、化工工业、国防等领域占有重要地位。
(1)已知反应NO2(g)+CO(g)=NO(g)+CO2(g)的能量变化如图所示,下列说法正确的是___。
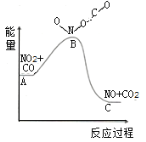
A.图中A→B的过程为放热过程
B.1molNO2和1molCO的键能总和大于1molNO和1molCO2的键能总和
C.该反应为氧化还原反应
D.1molNO2(g)和1molCO(g)的总能量低于1molNO(g)和1molCO2(g)的总能量
(2)N2O4与NO2之间存在反应N2O4(g)![]() 2NO2(g)。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度的变化如图所示。
2NO2(g)。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度的变化如图所示。
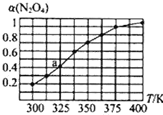
①由图推测该反应的△H___0(填“>”或“<”),理由为___。
②图中a点对应温度下,已知N2O4的起始压强为108kPa,则该温度下反应的平衡常数Kp=__kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
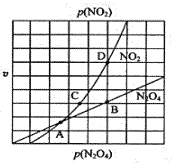
③在一定条件下,该反应N2O4、NO2的消耗速率与自身压强间存在关系v(N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),其中k1、k2是与反应温度有关的常数。相应的速率压强关系如图所示,一定温度下,k1、k2与平衡常数Kp的关系是k1=__。
(3)以四甲基氯化铵[(CH3)4NCl]水溶液为原料,通过电解法可以制备四甲基氢氧化铵[(CH3)4NOH],装置如图所示。
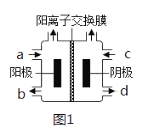
①收集到(CH3)4NOH的区域是___(填a、b、c或d)。
②写出电解池总反应(化学方程式)___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,改变反应物中n(SO2),对反应2SO2(g)+O2(g)2SO3(g) ΔH<0的影响如图所示,下列说法正确的是( )
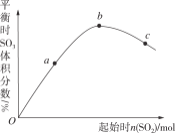
A.反应bc点均为平衡点,a点未达到平衡且向正反应方向进行
B.abc三点的平衡常数Kb>Kc>Ka
C.上述图象可以得出SO2的含量越高得到的混合气体中SO3的体积分数越高
D.abc三点中,a点时SO2的转化率最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.甲烷的燃烧热为890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)H=-890.3kJ/mol
B.同种金属作为原电池的正极比作为电解池的阳极腐蚀得更快
C.向稀硫酸与蔗糖共热后的溶液中滴加银氨溶液,水浴加热,未见银镜,不能说明蔗糖没有水解
D.![]() 的二氯代物有三种
的二氯代物有三种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的化工原料,广泛应用于化工生产,也可直接用作燃料。已知:
CH3OH(l)+O2(g)![]() CO(g)+2H2O(g)
CO(g)+2H2O(g)![]() ;
;
2CO(g)+O2(g)![]() 2CO2(g)
2CO2(g)![]() 。
。
下列说法或热化学方程式正确的是
A.CO的燃烧热为![]()
B.2 mol CO和1 mol O2的总能量比2 mol CO2的总能量低
C.2CH3OH(l)+3O2(g)![]() 2CO2(g)+4H2O(g)
2CO2(g)+4H2O(g)![]()
D.完全燃烧16g甲醇,生成一氧化碳和水时放出的热量为221.82 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法不正确的是
A.盖斯定律实质上是能量守恒定律的体现
B.在加热条件下进行的反应不一定是吸热反应
C.由3O2(g)=2O3(g)H=+284.2kJ/mol,可知O2比O3稳定
D.已知,H2(g)的燃烧热是H=-285.8kJ/mol,则2H2O(l)=2H2(g)+O2(g) H=+285.8kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钡在氧气中燃烧时得到一种钡的氧化物晶体,结构如图所示,有关说法不正确的是( )

A. 该晶体属于离子晶体
B. 晶体的化学式为Ba2O2
C. 该晶体晶胞结构与NaCl相似
D. 与每个Ba2+距离相等且最近的Ba2+共有12个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com