
【题目】乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室制取乙酸乙酯的主要步骤如下:

①在甲试管(如图)中加入2mL浓硫酸、3mL乙醇和2mL乙酸的混合溶液。
②按如图连接好装置(装置气密性良好)并加入混合液,小火均匀地加热3—5min。
③待试管乙收集到一定量产物后停止加热,撤出试管并用力振荡,然后静置待分层。
④分离出乙酸乙酯层、洗涤、干燥。
(1) 写出该反应的化学方程式是:_______________________;
(2) 与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是____________。
(3)甲试管中,混合溶液的正确加入顺序:________________________;
(4)步骤②中需要用小火均匀加热,其主要原因是____________________________________;
(5)上述实验中饱和碳酸钠溶液的作用是____________(填字母代号)。
A. 反应掉乙酸和乙醇 B. 反应掉乙酸并吸收乙醇
C. 析出乙酸乙酯 D. 加速酯的生成,提高其产率
(6)欲将乙试管中的物质分离开以得到乙酸乙酯,必须使用的仪器是____________;分离时,乙酸乙酯应该从仪器____________(填:“下口放”或“上口倒”)出。
【答案】CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O 防倒吸 乙醇,浓硫酸,乙酸 防止乙醇与乙酸剧烈沸;防止乙酸乙酸挥发过快;防止试管受热不均而炸裂 BC 分液漏斗 上口倒
CH3COOCH2CH3+H2O 防倒吸 乙醇,浓硫酸,乙酸 防止乙醇与乙酸剧烈沸;防止乙酸乙酸挥发过快;防止试管受热不均而炸裂 BC 分液漏斗 上口倒
【解析】
实验室用乙酸与乙醇在浓硫酸作催化剂和吸水剂时反应生成乙酸乙酯,乙酸乙酯难溶于水,密度比水小,反应过程中生成的乙酸乙酯呈气态,经过冷凝变成液体,会引起装置中气体压强的变化,因此需要防止倒吸,结合实验的基本操作和实验注意事项分析解答。
(1)乙酸与乙醇生成乙酸乙酯,反应的化学方程式为CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O,故答案为:CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O,故答案为:CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;
(2) 与教材采用的实验装置不同,此装置中采用了球形干燥管,可以起到防止倒吸的作用,故答案为:防倒吸;
(3)浓硫酸溶于水放出大量的热,加入药品时,为防止酸液飞溅,应先加入乙醇再加入浓硫酸和乙酸,故答案为:乙醇,浓硫酸,乙酸;
(4)步骤②中需要用小火均匀加热,可以防止乙醇与乙酸剧烈沸;防止乙酸乙酸挥发过快;防止试管受热不均而炸裂,故答案为:防止乙醇与乙酸剧烈沸;防止乙酸乙酸挥发过快;防止试管受热不均而炸裂;
(5)制备乙酸乙酯时,常用饱和碳酸钠溶液吸收乙酸乙酯,目的是中和乙酸并吸收部分乙醇、乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出,所以BC正确,故答案为:BC;
(6)分离粗产品乙酸乙酯、乙酸和乙醇的混合物,加入饱和碳酸钠溶液,实现酯与乙酸和乙醇的分离,分离油层和水层采用分液的方法,所以用到的仪器为分液漏斗;乙酸乙酯的密度比水小,所以在碳酸钠溶液层上方有无色油状液体出现,分离时,乙酸乙酯应该从分液漏斗的上口倒出,故答案为:分液漏斗;上口倒。


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】废水脱氮工艺中有一种方法是在废水中加入NaClO使NH4+完全转化为N2,该反应可表示为2NH4++3ClO-=N2↑+3Cl-+2H++3H2O。下列说法中,不正确的是( )
A.反应中氮元素被氧化
B.还原性NH4+>Cl-
C.反应中氯元素被还原
D.经此法处理过的废水可以直接排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是几则广告语,请判断在上述广告语中,有多少条在科学性上有明显的错误?
①这种食品由纯天然谷物制成,不含任何糖类,糖尿病患者也可放心大量食用
②这种饮料含有多种无机盐,能有效补充人体运动时消耗的能量
③这种矿泉水含有人体所需的部分大量元素和微量元素
④这种口服液含有丰富的钙、铁、锌、硒等微量元素
A. 1条 B. 2条 C. 3条 D. 4条
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中,作为生命活动的体现者、遗传信息的携带者、膜结构基本支架的依次是
A. 糖类,脂类、核酸 B. 蛋白质、核酸、磷脂
C. 蛋白质、糖类、核酸 D. 蛋白质、磷脂、核酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备及 A 中酒精灯已略)。
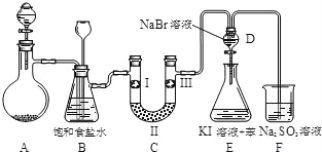
(1)实验室制氯气的离子方程式为_____。
(2)装置 B 中饱和食盐水的作用是_____;请写出装置 B 的另一个作用_______________________________。
(3)装置 C 的实验目的是验证氯气是否具有漂白性, 为此 C 中Ⅰ、Ⅱ、Ⅲ依次放入物质的组合是_______________(填编号)。
编号 | a | b | c | d |
Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(4)设计装置 D、E 的目的是比较氯、溴、碘的非金属性。反应一段时间后,打开活塞,将装置 D 中少量溶液加入装置 E 中,振荡,静置,观察到的现象是_____,该现象不能说明溴的非金属性强于碘,原因是_________。
(5)装置 F 中所发生的离子反应方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于离子浓度的叙述正确的是
A. 0.1mol·L-1氨水中,c(OH-) = c(NH4+)
B. 25℃时,pH = 3的盐酸和pH = 11的氨水等体积混合后所得溶液中,c(H+ )>c(OH—)
C. 0.1mol·L-1某二元弱酸强碱盐NaHA溶液中,c(Na+) = 2c(A2-)+ c(HA-)+c(H2A)
D. c(NH4+) 相等NH4Cl、NH4HSO4和NH3·H2O溶液中,c(NH3·H2O)>c(NH4Cl)>c(NH4HSO4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列现象不能说明浓硫酸具有强氧化性的是
A.能用铝槽车运输浓硫酸
B.浓硫酸能与不活泼金属在加热条件下反应
C.浓硫酸滴到白纸上,使白纸变黑
D.不活泼非金属单质能与浓硫酸反应生成CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知:反应aA(g)+bB(g)cC(g),某温度下,在 2 L 的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。

(1)经测定前4 s内v(C)=0.05 mol·L1·s1,则该反应的化学方程式为______________。
(2)若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为甲:v(A)=0.3 mol·L1·s1;乙:v(B)=0.12 mol·L1·s1;丙:v(C)=9.6 mol·L1·min1,则甲、乙、丙三个容器中反应速率由快到慢的顺序为___________(用甲、乙、丙表示)。
Ⅱ.为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题。
编号 | 操作 | 实验现象 |
① | 分别在试管A、B中加入5 mL 5% H2O2溶液,各滴入1~2 滴1 mol/L FeCl3溶液。待试管中均有适量气泡出现时,将试管A放入盛有5 ℃左右冷水的烧杯中;将试管B放入盛有40 ℃左右热水的烧杯中 | 试管A中不再产生气泡试管B中产生的气泡量增大 |
② | 另取两支试管分别加入5 mL 5% H2O2溶液和5 mL 10% H2O2溶液 | 试管A、B中均未见气泡产生 |
(3)实验①的目的是_______________________________,实验中滴加FeCl3溶液的目的是____________________________。
(4)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是______________________________________________________________(用实验中所提供的几种试剂)。

(5)某同学在50 mL H2O2 溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如右图所示,则A、B、C三点所表示的即时反应速率最慢的是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2A(g)![]() 2B(g)+E(g) ΔH>0,达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是( )
2B(g)+E(g) ΔH>0,达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是( )
A. 加压 B. 升温 C. 减少E的浓度 D. 降温
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com