
【题目】氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3e-=NO↑+2H2O;已知KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该反应的离子方程式;用“单线桥法”标出电子转移的方向和数目: _______________。
(2)反应中硝酸体现了_________、_________性质。
(3)反应中若转移3mol电子,则在标况下产生的气体体积是________L。
【答案】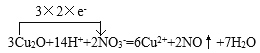 酸性 氧化性 22.4
酸性 氧化性 22.4
【解析】
(1)NO3-在酸性条件下表现氧化性,则加入的物质应该检验还原性,结合元素化合价与物质性质的关系分析判断;
(2)根据反应前后硝酸中元素化合价变化情况判断物质的作用;
(3)利用1 molHNO3作氧化剂得到3 mol电子变为NO气体,利用V=n·Vm计算气体的体积。
(1)根据已知方程式NO3-+4H++3e-=NO↑+2H2O可知在反应中NO3-在酸性条件下表现氧化性,则加入的物质应该表现还原性;在KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中,在KMnO4、Na2CO3、Fe2(SO4)3中的Mn、C、Fe元素都处在最高价,则具有氧化性,只有Cu2O中Cu处在较低价,则具有还原性,可以发生上述反应,根据电子守恒、原子守恒,可得反应的化学方程式为3Cu2O+14HNO3=6Cu(NO3)2+2NO↑+7H2O,该反应的离子方程式为:3Cu2O+14H++2NO3-=6Cu2++2NO↑+7H2O,用单线桥法表示电子转移为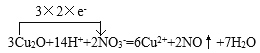 ;
;
(2)在上述反应中,硝酸一部分未参加氧化还原反应,硝酸铜体现硝酸的酸性;另一部分得到电子,被还原产生NO,表现酸性,所以硝酸的作用表现为氧化性和酸性;
(3)根据方程式可知:每1 molHNO3作氧化剂,得到3 mol电子反应产生1 molNO气体,所以若反应中转移的电子总数为3 mol,则生成气体为1 mol,在标准状况下的体积V(NO)=1 mol×22.4 L/mol=22.4 L。


科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.二溴乙烷和水、溴苯和水、硝基苯和水三对物质都能用分液漏斗进行分离
B.苯与甲烷都不能使酸性高锰酸钾褪色,而甲苯能使酸性高锰酸钾褪色,则苯环使得甲基活化
C.甲苯与足量![]() 加成的产物的一氯代物有5种同分异构体
加成的产物的一氯代物有5种同分异构体
D.在溴乙烷中加入适量的氢氧化钠溶液,加热一段时间,再滴入几滴硝酸银溶液,会有沉淀析出,则溴乙烷在碱性条件下能水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了研究反应![]() 的能量变化情况,某同学设计了如图所示实验装置。当向盛有固体A(A不与水反应)的试管中滴加溶液B时,发现U形管中甲处液面下降,乙处液面上升。试回答下列问题。
的能量变化情况,某同学设计了如图所示实验装置。当向盛有固体A(A不与水反应)的试管中滴加溶液B时,发现U形管中甲处液面下降,乙处液面上升。试回答下列问题。

(1)所发生的反应________(填“放出”或“吸收”)热量。
(2)参加反应的A和B的总能量________(填“高于”或“低于”)生成的C和D的总能量。
(3)该反应中物质的化学能通过化学反应转化成________释放出来。
(4)该反应中,断裂反应物中化学键吸收的能量________(填“高于”或“低于”)形成生成物中化学键放出的能量。
(5)写出一个符合题中条件的化学方程式:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】淀粉通过如图所示转化可以得到多种有机物:
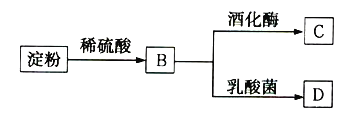
(1)检验淀粉是否完全水解,可以选用的试剂是__________(填序号)。
a.石蕊试液 b.淀粉碘化钾溶液 c.碘水
(2)B是一种单糖,则B的名称是____________________。
(3)B转化为C的化学方程式是______________________________。
(4)一分子B可在乳酸菌作用下分解生成两分子D,D与乙酸、乙醇均能发生酯化反应,且D的结构中含有甲基,则D的结构简式是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.碳素钢在海水中发生的腐蚀主要是析氢腐蚀
B.在铁制品表面镀锌时,铁制品与电源正极相连
C.NaHCO3溶液的水解方程式为:HCO![]() +H2O
+H2O![]() CO
CO![]() +H3O+
+H3O+
D.已知室温时Ksp[Mg(OH)2]=5.6×10-12,室温下pH=8的Mg(OH)2悬浊液中c(Mg2+)=5.6mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
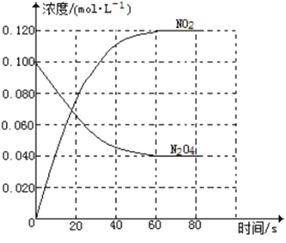
回答下列问题:
(1)反应的△H______0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,反应速率v(N2O4)为___________molL-1s-1反应的平衡常数K1为___________。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 molL-1s-1的平均速率降低,经10s又达到平衡。
①T_______100℃(填“大于”“小于”),判断理由是_____。
②列式计算温度T是反应的平衡常数K2___________
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向___________(填“正反应”或“逆反应”)方向移动,判断理由是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M具有抗氧化、抗肿瘤作用,其结构简式如图所示。下列有关M的说法正确的是( )
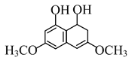
A.一定条件下M可发生加成、氧化、消去等反应
B.M与Na、NaOH溶液、NaHCO3溶液均能发生反应
C.1molM与浓溴水充分反应,最多消耗Br2的物质的量为4mol
D.M分子中含有1个手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2L的恒容密闭容器中充入气体A和气体B发生反应生成气体C,反应过程中各组分的物质的量随反应时间的变化如图所示。下列说法正确的是( )
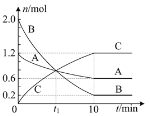
A.t1时刻反应达到平衡状态
B.0~10min内平均速率v(B)=0.18mol·L-1·min-1
C.该反应的化学方程式可表示为:A+3B![]() 2C
2C
D.该温度下,反应的平衡常数为1200
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列相关离子方程式书写正确的是![]()
A.![]() 溶液与少量的氢氧化钠溶液混合加热:
溶液与少量的氢氧化钠溶液混合加热:![]()
B.向![]() 溶液中加入过量的澄清石灰水:
溶液中加入过量的澄清石灰水:![]()
C.等物质的量的![]() 和
和![]() 在溶液中的反应:
在溶液中的反应:![]()
D.“84消毒液”和“洁厕灵”![]() 主要成分为盐酸
主要成分为盐酸![]() 混合使用会产生有毒气体:
混合使用会产生有毒气体:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com