
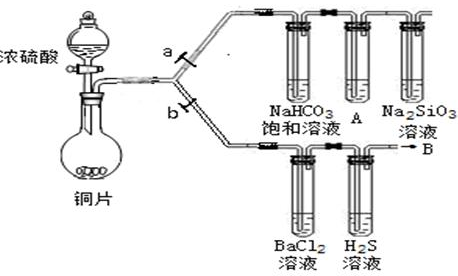
| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化学式 | | |
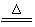 CuSO4 + SO2↑+ 2H2O KMnO4溶液
CuSO4 + SO2↑+ 2H2O KMnO4溶液| | | |
| | BaSO4 | BaSO3 |
 CuSO4 + SO2↑+ 2H2O KMnO4溶液
CuSO4 + SO2↑+ 2H2O KMnO4溶液| | | |
| | BaSO4 | BaSO3 |
 CaCO3↓+H2O,Ca(OH)2恰好反应完时沉淀质量最大,此时可由0.01 mol CO2来算Ca(OH)2和CaCO3的物质的量为0.01 mol。第二步反应为KOH+CO2
CaCO3↓+H2O,Ca(OH)2恰好反应完时沉淀质量最大,此时可由0.01 mol CO2来算Ca(OH)2和CaCO3的物质的量为0.01 mol。第二步反应为KOH+CO2 KHCO3,KOH的质量为(1.3-0.01×74)g="0.56" g,所以n(KOH)="0.01" mol,第二步消耗的CO2也为0.01 mol ,第三步CaCO3+CO2+H2O
KHCO3,KOH的质量为(1.3-0.01×74)g="0.56" g,所以n(KOH)="0.01" mol,第二步消耗的CO2也为0.01 mol ,第三步CaCO3+CO2+H2O Ca(HCO3)2,又消耗0.01 mol CO2。最后一问上面第二步反应沉淀最大且质量不变,消耗CO2的值为0.01mol―0.02mol之间,体积为224mL ≤ V ≤ 448mL。
Ca(HCO3)2,又消耗0.01 mol CO2。最后一问上面第二步反应沉淀最大且质量不变,消耗CO2的值为0.01mol―0.02mol之间,体积为224mL ≤ V ≤ 448mL。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源:不详 题型:实验题
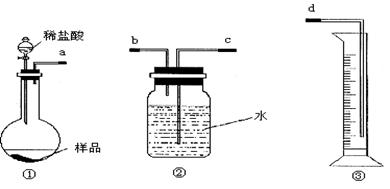
| A.在滴入盐酸之前,应排净装置内的CO2气体 |
| B.在装置①中稀盐酸换成稀硫酸,装置②中水换成饱和NaHCO3溶液 |
| C.在装置②中水换成饱和Na2CO3溶液 |
| D.滴加盐酸不宜过快 |
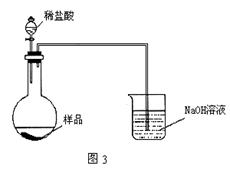
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
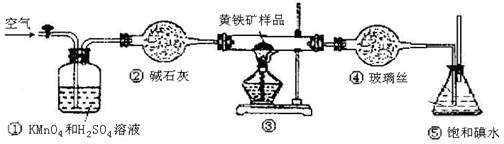
| 滴定次数 | 待测液体的体积/mL | 标准碱溶液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 第一次 | 20.00mL | 0.00 | 20.58 |
| 第二次 | 20.00mL | 0.22 | 20.20 |
| 第三次 | 20.00mL | 0.36 | 20.38 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题


查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
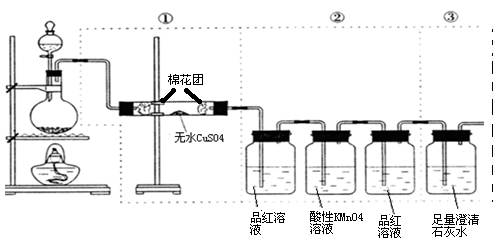
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
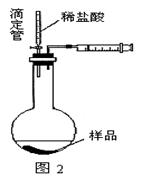
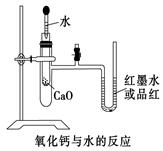
 象是 ,说明反应放热。(下列装置中支撑及捆绑等仪器已略去)
象是 ,说明反应放热。(下列装置中支撑及捆绑等仪器已略去)
 。
。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| | A | B | C | D |
| 纸蝴蝶上的喷洒液 | 石蕊 | 酚酞 | 酚酞 | 石蕊 |
| 小烧坏中的溶液 | 浓盐酸 | 浓氨水 | 氢氧化钠溶液 | 浓硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com