
【题目】研究NOx、SO2、CO等大气污染气体的处理具有重要意义。
(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S。已知:
①CO(g)+![]() O2(g)===CO2(g) ΔH=283.0 kJ·mol1
O2(g)===CO2(g) ΔH=283.0 kJ·mol1
②S(s)+O2(g)===SO2(g) ΔH=296.0 kJ·mol1
此反应的热化学方程式是___________________________________。
(2)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
CO(g)+NO2(g)===NO(g)+CO2(g) ΔH=a kJ·mol1(a>0)
2CO(g)+2NO(g)===N2(g)+2CO2(g) ΔH=b kJ·mol1(b>0)
若用标准状况下3.36 L CO还原NO2至N2(CO完全反应)的整个过程中转移电子的物质的量为________mol,放出的热量为______________kJ(用含有a和b的代数式表示)。
(3)用CH4催化还原NOx也可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH1=574 kJ·mol1①
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH2=?②
若1 mol CH4还原NO2至N2,整个过程中放出的热量为867 kJ,则ΔH2=________。
【答案】(1)2CO(g)+SO2(g)===S(s)+2CO2(g) ΔH=270 kJ·mol1(2分)
(2)0.3(2分) 3(2a+b)/80(3分)
(3)1 160 kJ·mol1(3分)
【解析】(1)依据题意知,处理烟道气污染的一种方法是将CO、SO2在催化剂作用下转化为单质S,对照反应①和②,并根据盖斯定律将反应①×2②可得答案。(2)假设两个反应分别为①、②,由①×2+②可得:4CO(g)+2NO2(g)===N2(g)+4CO2(g) ΔH=(2a+b)kJ·mol1,反应中转移电子为8e。因此标准状况下的3.36 L CO还原NO2时,转移电子为![]() ×8 mol=0.3 mol,放出的热量为
×8 mol=0.3 mol,放出的热量为![]() ×(2a+b)=3(2a+b)/80 kJ。(3)CH4还原NO2至N2的热化学方程式为CH4(g)+2NO2(g)===N2(g)+CO2(g)+2H2O(g) ΔH=867 kJ·mol1,根据盖斯定律,ΔH=
×(2a+b)=3(2a+b)/80 kJ。(3)CH4还原NO2至N2的热化学方程式为CH4(g)+2NO2(g)===N2(g)+CO2(g)+2H2O(g) ΔH=867 kJ·mol1,根据盖斯定律,ΔH=![]() (ΔH1+ΔH2),解得ΔH2=867 kJ·mol1×2(574 kJ·mol1)= 1 160 kJ·mol1。
(ΔH1+ΔH2),解得ΔH2=867 kJ·mol1×2(574 kJ·mol1)= 1 160 kJ·mol1。


科目:高中化学 来源: 题型:
【题目】下列物质混合后,不会发生离子反应的是( )
A. 硝酸银溶液和氯化钠溶液 B. 氯化钙溶液和稀硫酸
C. 氯化镁溶液和硫酸铜溶液 D. 澄清的石灰水和稀盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3+5O2=4NO+6H2O 在5L的密闭容器中进行,30s后,NO的物质的量增加了0.3mol,则此反应的平均速率可表示为( )
A.v(O2)=0.0025 mol/(Ls)
B.v(NO)=0.008 mol/(Ls)
C.v(H2O)=0.003 mol/(Ls)
D.v(NH3)=0.002 mol/(Ls)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质能相互反应得到Al(OH)3的是
A. 铝跟NaOH溶液
B. Al(NO3)3跟过量的NaOH溶液
C. Al2O3和热水
D. Al2(SO4)3溶液跟过量的氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种以黄铜矿和硫磺为原料制取铜和其他产物的新工艺,原料的综合利用率较高.其主要流程如下.请回答下列问题: 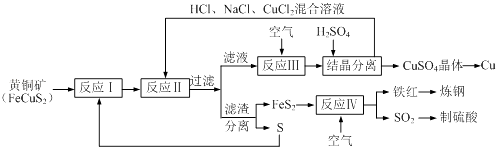
(1)反应Ⅲ的离子方程式为4CuCl2﹣+O2+4H+═4Cu2++8Cl﹣+2H2O,CuCl2﹣中铜元素的化合价为 , 该反应中的氧化剂是 .
(2)一定温度下,在反应Ⅲ所得的溶液中加入硫酸,可以析出硫酸铜晶体而不析出氯化铜晶体,其原因可能是 .
(3)炼钢时,可将铁红投入熔融的生铁中,以降低生铁的含碳量,该过程中主要反应的化学方程式是 .
(4)SO2尾气直接排放到大气中造成环境污染的后果是 .
(5)已知反应Ⅱ的离子方程式为Cu2++CuS+4Cl﹣═2CuCl2﹣+S,反应Ⅰ的产物为和 . (填化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W代表短周期的四种元素,有关它们的部分信息如表所示:
元素 | 部分结构特点 | 部分性质 |
X | X的单质由双原子分子构成,分子中有14 | X有多种氧化物,如XO、XO2等 |
Y | Y原子的次外层电子数等于最外层电子数 | Y元素能形成多种单质 |
Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价的代数和等于6 |
W | 第三周期元素的简单离子中半径最小 | W的单质化学性质虽较活泼,但只需常温保存 |
请按要求回答下列问题(注意不能用字母X、Y、Z、W作答,请用相应的元素符号或化学式填写):
(1)X的元素名称是,X的气态氢化物的电子式是 .
(2)Z元素在周期表中的位置是第周期,第族.Z和W形成的化合物属于化合物(填“离子”或“共价”).
(3)X、Y、Z、W的原子半径从大到小的顺序是 .
(4)X、Y、Z三种元素的最高价氧化物的水化物的酸性由强到弱的顺序是: .
(5)铜和X的最高价氧化物的水化物的浓溶液反应的化学方程式: .
(6)气体分子(YX)2称为拟卤素,性质与卤素类似,请写出(YX)2与NaOH溶液反应的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 已知冰的熔化热为6.0kJ·mol-1,冰中氢键键能为20kJmol-1,假设每摩尔冰中有2mol氢键,且熔化热完全用于打破冰的氢键,则最多只能破坏冰中15%的氢键
B. 已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为a,Ka=(ca)2/c(1-a)。若加水稀释,,则CH3COOH![]() CH3COO-+H+向右移动,a增大,Ka不变
CH3COO-+H+向右移动,a增大,Ka不变
C. 甲烷的标准燃烧热为-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ·mol-1
D. 500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6kJ·mol-1
2NH3(g) △H=-38.6kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com