
【题目】反应4NH3+5O2=4NO+6H2O 在5L的密闭容器中进行,30s后,NO的物质的量增加了0.3mol,则此反应的平均速率可表示为( )
A.v(O2)=0.0025 mol/(Ls)
B.v(NO)=0.008 mol/(Ls)
C.v(H2O)=0.003 mol/(Ls)
D.v(NH3)=0.002 mol/(Ls)
【答案】ACD
【解析】解:半分钟后NO的物质的量增加了0.3mol,所以用NO表示的反应速率为v(NO)= ![]() =0.002mol/(Ls).
=0.002mol/(Ls).
A、根据速率之比等于化学计量数之比,所以v(O2)= ![]() v(NO)=×0.002mol/(Ls)=0.0025mol/(Ls),故A正确;
v(NO)=×0.002mol/(Ls)=0.0025mol/(Ls),故A正确;
B、半分钟后NO的物质的量增加了0.3mol,所以用NO表示的反应速率为v(NO)=0.002mol/(Ls),故B错误;
C、根据速率之比等于化学计量数之比,所以v(H2O)=1.5v(NO)=1.5×0.002mol/(Ls)=0.003mol/(Ls),故C正确;
D、根据速率之比等于化学计量数之比,所以v(NH3)=v(NO)=0.002mol/(Ls),故D正确.
故选ACD.
【考点精析】利用反应速率的定量表示方法对题目进行判断即可得到答案,需要熟知反应速率的单位:mol/(L·min)或mol/(L·s) v=△c-△t.


科目:高中化学 来源: 题型:
【题目】要证明氯乙烷中氯元素的存在可进行如下操作,其中顺序正确的是( )
①加入AgNO3溶液;②加入NaOH溶液;③加热;④加入蒸馏水;⑤加入HNO3酸化
A. ②③⑤① B. ④③⑤① C. ④①⑤ D. ②③①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017天津]常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A.增加c(CO),平衡向正向移动,反应的平衡常数增大
B.第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
C.第二阶段,Ni(CO)4分解率较低
D.该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CO(g)+O2(g)![]() 2CO2(g) ΔH=566 kJ·mol1;Na2O2(s)+CO2(g)
2CO2(g) ΔH=566 kJ·mol1;Na2O2(s)+CO2(g)![]() Na2CO3(s)+
Na2CO3(s)+![]() O2(g) ΔH=226 kJ·mol1
O2(g) ΔH=226 kJ·mol1
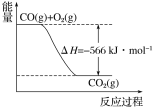
根据以上热化学方程式和图像判断,下列说法正确的是
A.CO的燃烧热为283 kJ
B.上图可表示由1 mol CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH>452 kJ·mol1
D.根据以上热化学方程式无法求算Na2O2(s)+CO(g)===Na2CO3(s)的反应热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的描述正确的是( )
A. 实验室配制CuCl2溶液时,需加入盐酸来抑制Cu2+水解
B. 定容时仰视容量瓶的刻度线,会导致所配溶液的浓度偏高
C. 用NaOH标准溶液滴定未知浓度的盐酸,未润洗锥形瓶会导致结果偏低
D. 称取2.0gNaOH固体时,先将天平调平,再将游码调至2.0g,向左盘加NaOH固体至天平平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事故处理方法正确的是( )
A. 凡是给玻璃仪器加热,都要加垫石棉网,以防仪器炸裂
B. 制取并用排水法收集氧气结束后,应立即停止加热
C. 浓NaOH溶液溅到皮肤上,立即用水冲洗,然后涂上稀硼酸溶液
D. 浓硫酸溅到皮肤上,立即用稀NaOH溶液洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NOx、SO2、CO等大气污染气体的处理具有重要意义。
(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S。已知:
①CO(g)+![]() O2(g)===CO2(g) ΔH=283.0 kJ·mol1
O2(g)===CO2(g) ΔH=283.0 kJ·mol1
②S(s)+O2(g)===SO2(g) ΔH=296.0 kJ·mol1
此反应的热化学方程式是___________________________________。
(2)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
CO(g)+NO2(g)===NO(g)+CO2(g) ΔH=a kJ·mol1(a>0)
2CO(g)+2NO(g)===N2(g)+2CO2(g) ΔH=b kJ·mol1(b>0)
若用标准状况下3.36 L CO还原NO2至N2(CO完全反应)的整个过程中转移电子的物质的量为________mol,放出的热量为______________kJ(用含有a和b的代数式表示)。
(3)用CH4催化还原NOx也可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH1=574 kJ·mol1①
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH2=?②
若1 mol CH4还原NO2至N2,整个过程中放出的热量为867 kJ,则ΔH2=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是不同温度下水的离子积数据:
温度/℃ | 25 | t1 | t2 |
水的离子积常数 | 1×10-14 | α | 1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则α____(填“<”“>”或“=”)1×10-14,作出此判断的理由是___________________。
(2)25 ℃下,某Na2SO4溶液中c(![]() )=5×10-4mol·L-1,取该溶液1 mL,加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)=________。
)=5×10-4mol·L-1,取该溶液1 mL,加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)=________。
(3)t2 ℃下,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=________。此溶液中各种离子的浓度由大到小的排列顺序是_______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com