
【题目】为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿烧渣(铁主要以Fe2O3存在)转变成重要的化工原料FeSO4(反应条件略)。

活化硫铁矿还原Fe3+的主要反应为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,不考虑其他反应。
(1)第Ⅰ步H2SO4与Fe2O3反应的离子方程式是___。
(2)检验第Ⅱ步中Fe3+是否完全还原,应选择___(填字母编号)。
A.KMnO4溶液 B.K3[Fe(CN)6]溶液 C.KSCN溶液
(3)在反应FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4中,有7molFe2(SO4)3参与反应,有__电子转移;
(4)FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料。该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+FeS2=Fe +2Li2S,正极反应式是___。
(5)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。FeCO3在空气中加热反应生成Fe2O3的化学方程式是___。
【答案】Fe2O3+6H+=2Fe3++3H2O C 14mol FeS2+4e-=Fe +2S2- 4FeCO3+O2![]() 2Fe2O3+4CO2
2Fe2O3+4CO2
【解析】
硫铁矿烧渣用硫酸浸取,过滤后滤液中含有硫酸铁、未反应的硫酸,用活化硫铁矿还原Fe3+后过滤,向滤液中加入FeCO3调节溶液pH,过滤后再通入空气、调节溶液pH,除去溶液中杂质离子,过滤浓缩结晶得到FeSO4晶体。
(1)H2SO4与Fe2O3反应生成硫酸铁与水,反应离子方程式为:Fe2O3+6H+=2Fe3++3H2O;
(2) 检验第Ⅱ步中Fe3+是否完全还原,即检验还原后的溶液中是否存在Fe3+;KMnO4溶液、K3[Fe(CN)6]溶液可以检验有Fe2+生成,而KSCN溶液用于检验Fe3+,操作为:取第Ⅱ步反应中溶液少许于试管中,滴加KSCN 溶液,若溶液不变红色,说明Fe3+完全被还原,故答案为:C;
(3)FeS2+7Fe2(SO4)3+8H2O═15FeSO4+8H2SO4中,FeS2中S元素的化合价由-1价升高为+6价,Fe2(SO4)3中Fe元素的化合价由+3价降低为+2价,由反应可知,有7molFe2(SO4)3参与反应时转移14mol电子;
(4)电池放电时的总反应为:4Li+FeS2=Fe+2Li2S,正极发生还原反应,FeS2获得电子生成Fe、S2-,正极电极反应式为:FeS2+4e-=Fe+2S2-;
(5)FeCO3在空气中加热反应生成Fe2O3的化学方程式是4FeCO3+O2![]() 2Fe2O3+4CO2。
2Fe2O3+4CO2。


科目:高中化学 来源: 题型:
【题目】一种新型漂白剂(如下图)可用于漂白羊毛等,其中W、Y、Z为不同周期不同主族的短周期元素,W、Y、Z的最外层电子数之和等于X的最外层电子数,W、X对应的简单离子核外电子排布相同。下列叙述正确的是

A.工业上通过电解熔融的WX来制得W
B.W、X对应的简单离子半径顺序为:W>X
C.Y的最高价氧化物对应水化物为弱酸
D.该漂白剂中各元素均满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲使用 450 mL 0.2 molL-1 CuSO4 溶液,配制该溶液包含以下步骤:
①称取一定质量胆矾(CuSO45H2O)、放入烧杯,用适量蒸馏水将其完全溶解;
②把溶液小心地注入容量瓶中;
③继续向容量瓶中加蒸馏水至凹液面距刻度线1~2cm 时,改用胶头滴管滴加,直到溶液的凹液面恰好与刻度线相切为止;
④用少量蒸馏水洗涤烧杯和玻璃棒2~3 次,每次洗涤液都转入容量瓶,并轻轻摇匀;
⑤将容量瓶塞好,充分摇匀。
请填写下列空白:
(1)应该称取胆矾的质量是_________。
(2)上述操作的正确顺序是_________。
(3)实验用到的仪器有托盘天平(砝码)、药匙、烧杯、玻璃棒__________等。
(4)下列情况中会导致所配溶液浓度偏小的是_________(填序号)。
a.容量瓶使用前未干燥
b.转移溶液后,烧杯没有洗涤
c.定容过程观察容量瓶内液面时,俯视刻度线
d.颠倒摇匀后,发现液面低于刻度线,不作任何处置
e.加蒸馏水时不慎超过刻度线,用胶头滴管小心地吸去超出部分,使凹液面底部与刻度线相切
(5)取 100 mL 所配溶液,向其中加入 1.68 g 铁粉,充分反应后,过滤,将固体洗涤、干燥后,再加入1 molL-1 稀硫酸至固体不再溶解。
试计算:
①至少需要稀硫酸 _________mL。
②固体溶解过程中产生氢气_________mL(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组学习了反应![]() 的相关知识后,欲探究镁是否与
的相关知识后,欲探究镁是否与![]() 气体反应,设计了下列实验装置图
气体反应,设计了下列实验装置图![]() 注:石棉绒是一种耐火材料,不参与反应
注:石棉绒是一种耐火材料,不参与反应![]() 。
。

请回答下列问题:
(1)仪器a的名称是______。
(2)若A中可供选择固体试剂有:木炭、铜片、亚硫酸钠固体,则装置A中发生反应的化学方程式为______。
(3)实验完毕后观察到石棉绒上有黄色物质生成,将石棉绒及其附着物投入到稀盐酸中,会产生具有臭鸡蛋气味的气体,则镁与SO2除发生SO2+2Mg![]() 2MgO+S反应外,还可能发生的反应是______。
2MgO+S反应外,还可能发生的反应是______。
(4)在装置C、D间插入图所示装置E,可以获得亚硫酸(H2SO3)溶液。

①实验完毕后,通过______![]() 实验操作名称
实验操作名称![]() 可以将E中上、下两层液体分开。
可以将E中上、下两层液体分开。
②向亚硫酸溶液中通入空气,溶液的pH会______![]() 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变”![]() ,其原因是______
,其原因是______![]() 用化学方程式表示
用化学方程式表示![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】10 mL某气态混合烃在80 mL O2中充分燃烧,得到体积为65 mL的混合气体(气体体积均在相同条件20℃时测定),则该混合物不可能是 ( )
A. 丙烷和丙烯 B. 乙烷和丙烯 C. 丙烯和丁炔 D. 丁烯和丙炔
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炒过菜的铁锅未及时洗净(残液中含NaCl),不久便会因被腐蚀而出现红褐色锈斑。腐蚀原理如图所示,下列说法正确的是
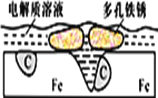
A. 腐蚀过程中,负极是C
B. Fe失去电子经电解质溶液转移给C
C. 正极的电极反应式为4OH―-4e-==2H2O+O2↑
D. C是正极,O2在C表面上发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,下列研究目的和示意图相符的是( )
2NH3(g) ΔH<0,下列研究目的和示意图相符的是( )
A | B | C | D | |
研究目的 | 压强对反应的影响(p2>p1) | 温度对反应的影响 | 平衡体系中增加N2的浓度对反应的影响 | 催化剂对反应的影响 |
示意图 |
|
|
|
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知重铬酸钾(K2Cr2O7)具有强氧化性,其还原产物Cr3+在水溶液中呈绿色或蓝绿色。在K2Cr2O7溶液中存在下列平衡:Cr2O72(橙色) + H2O![]() 2CrO42(黄色) + 2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是( )
2CrO42(黄色) + 2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是( )

A.①中溶液橙色加深,③中溶液变黄
B.②中Cr2O72被C2H5OH还原
C.对比②和④可知K2Cr2O7酸性溶液氧化性强
D.若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com