
【题目】某实验小组学习了反应![]() 的相关知识后,欲探究镁是否与
的相关知识后,欲探究镁是否与![]() 气体反应,设计了下列实验装置图
气体反应,设计了下列实验装置图![]() 注:石棉绒是一种耐火材料,不参与反应
注:石棉绒是一种耐火材料,不参与反应![]() 。
。

请回答下列问题:
(1)仪器a的名称是______。
(2)若A中可供选择固体试剂有:木炭、铜片、亚硫酸钠固体,则装置A中发生反应的化学方程式为______。
(3)实验完毕后观察到石棉绒上有黄色物质生成,将石棉绒及其附着物投入到稀盐酸中,会产生具有臭鸡蛋气味的气体,则镁与SO2除发生SO2+2Mg![]() 2MgO+S反应外,还可能发生的反应是______。
2MgO+S反应外,还可能发生的反应是______。
(4)在装置C、D间插入图所示装置E,可以获得亚硫酸(H2SO3)溶液。

①实验完毕后,通过______![]() 实验操作名称
实验操作名称![]() 可以将E中上、下两层液体分开。
可以将E中上、下两层液体分开。
②向亚硫酸溶液中通入空气,溶液的pH会______![]() 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变”![]() ,其原因是______
,其原因是______![]() 用化学方程式表示
用化学方程式表示![]() 。
。
【答案】(球形)干燥管 Na2SO3+H2SO4 (浓)=Na2SO4+SO2↑+H2O Mg+S![]() MgS(或SO2+3Mg
MgS(或SO2+3Mg![]() MgS+2MgO) 分液 减小
MgS+2MgO) 分液 减小 ![]()
【解析】
装置A制备二氧化硫,B是干燥装置,C是发生装置,D是尾气处理装置,结合实验原理和相关物质的性质分析解答。
(1)观察仪器a可知为名称为球形干燥管,在尾气处理过程中的作用是为防止倒吸。
(2)装置A是制取SO2气体装置,但Cu或木炭与浓硫酸反应需要加热,根据装置不加热特点可知反应为浓硫酸和亚硫酸钠反应,反应的化学方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
(3)实验完毕后观察到石棉绒上有黄色物质生成,将石棉绒及其附着物投入到稀盐酸中,会产生具有臭鸡蛋气味的气体,说明生成物中含有硫化物MgS,则镁与SO2除发生SO2+2Mg![]() 2MgO+S反应外,还可能发生的反应是Mg+S
2MgO+S反应外,还可能发生的反应是Mg+S![]() MgS(或SO2+3Mg
MgS(或SO2+3Mg![]() MgS+2MgO)。
MgS+2MgO)。
(4)①实验完毕后,液体分为上、下两层,可采用分液方法分离。
②亚硫酸是弱酸,亚硫酸有强还原性,极易被氧气氧化生成强酸硫酸,溶液的酸性增强,反应的化学方程式为2H2SO3+O2=2H2SO4,因此向亚硫酸溶液中通入空气,溶液的pH会减小。


科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法不正确的是
A. 向![]() 溶液中通入
溶液中通入![]() ,
,![]() 减小
减小
B. 将![]() 的
的![]() 溶液从
溶液从![]() 升温至
升温至![]() ,
,![]() 增大
增大
C. 向![]() 的HF溶液中滴加NaOH溶液至中性,
的HF溶液中滴加NaOH溶液至中性,![]() =1
=1
D. 向![]() 的
的![]() 溶液中加入少量水,
溶液中加入少量水,![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,
时,![]() 的
的![]() ,
,![]() ,室温下向10mL
,室温下向10mL![]() 溶液中逐滴加入
溶液中逐滴加入![]() 溶液,如图是溶液中含碳元素微粒物质的量分数随pH降低而变化的图象
溶液,如图是溶液中含碳元素微粒物质的量分数随pH降低而变化的图象![]() 因有逸出未画出
因有逸出未画出![]() 。下列说法错误的是
。下列说法错误的是![]()
A.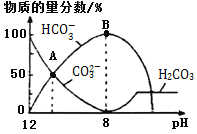
A点所示溶液的![]()
B.B点所示溶液:![]()
C.A点![]() 点发生反应的离子方程式为
点发生反应的离子方程式为![]()
D.Na2CO3溶液中,c(Na+)+c(H+)=2C(CO32-)+c(![]() )+c(OH-)
)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业流程中,进入反应塔的混合气体中NO和O2的物质的量分数分别为0.10和0.06,发生化学反应2NO(g)+O2(g)=2NO2(g),在其他条件相同时,测得实验数据如下表:
压强/(×105Pa) | 温度/℃ | NO达到所列转化率需要时间/s | ||
50% | 90% | 98% | ||
1.0 | 30 | 12 | 250 | 2830 |
90 | 25 | 510 | 5760 | |
8.0 | 30 | 0.2 | 3.9 | 36 |
90 | 0.6 | 7.9 | 74 | |
根据表中数据,下列说法正确的是
A. 升高温度,反应速率加快
B. 增大压强,反应速率变慢
C. 在1.0×105Pa、90℃条件下,当转化率为98%时的反应已达到平衡
D. 若进入反应塔的混合气体为amol,反应速率以v=△n/△t表示,则在8.0×105Pa、30℃条件下转化率从50%增至90%时段NO的反应速率为4a/370mol/s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或有关化学用语的表达正确的是( )
A.在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量
B.基态Fe原子的价电子轨道表示式:![]()
C.因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大
D.根据原子核外电子排布的特点,Cu在周期表中属于s区元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冬青油是一种无色液体,某实验小组利用如图所示的装置制备冬青油。化学反应原理和实验装置如下所示:
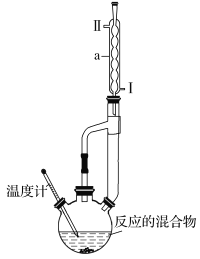
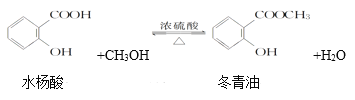
产物的有关数据如表所示:
相对分子质量 | 密度/g·cm-3 | 沸点/℃ | 溶解性 | |
冬青油 | 152 | 1.180 | 222.2 | 微溶于水 |
实验步骤如下所示:
①向三颈瓶中加入6.9g(0.05mol)水杨酸和24g(0.75mol)甲醇,再小心地加入6mL浓硫酸,摇匀。
②加入2粒沸石(或碎瓷片),装上仪器a,在石棉网上保持温度在85~95℃,回流1.5h。
③反应完毕,将烧瓶冷却,加入50mL蒸馏水,然后转移至分液漏斗,弃去水层,将有机层再倒入分液漏斗中,依次用50mL5%碳酸氢钠溶液和30 mL水洗涤。
④将产物移至干燥的锥形瓶中,加入0.5g无水氯化钙。
⑤最后将粗产品进行蒸馏,收集221~224℃的馏分,其质量为6.8g。
请回答下列问题:
(1)本实验中浓硫酸的作用是___。
(2)装置中仪器a的名称是___,进水口为___(填“Ⅰ”或“Ⅱ”)。温度计的适宜规格为___(填代号)。
①50℃ ②100℃ ③300℃
(3)用碳酸氢钠溶液洗涤的目的是___;用水洗涤时,产品在___(填“上”或“下”)层。
(4)加入无水氯化钙的目的是____。
(5)本次实验中冬青油的产率为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿烧渣(铁主要以Fe2O3存在)转变成重要的化工原料FeSO4(反应条件略)。

活化硫铁矿还原Fe3+的主要反应为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,不考虑其他反应。
(1)第Ⅰ步H2SO4与Fe2O3反应的离子方程式是___。
(2)检验第Ⅱ步中Fe3+是否完全还原,应选择___(填字母编号)。
A.KMnO4溶液 B.K3[Fe(CN)6]溶液 C.KSCN溶液
(3)在反应FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4中,有7molFe2(SO4)3参与反应,有__电子转移;
(4)FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料。该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+FeS2=Fe +2Li2S,正极反应式是___。
(5)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。FeCO3在空气中加热反应生成Fe2O3的化学方程式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把一块镁铝合金投入到1mol/L盐酸里,待合金完全溶解后,往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图A所示。下列说法中不正确的是( )

A.a的取值范围为0≤a<50
B.![]() 的最大值为2.5
的最大值为2.5
C.若将关系图改为B图时,则a的取值范围为80<a<90
D.若将关系图改为C图时,则a的取值范围为75<a<90
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用有关概念判断下列叙述正确的是( )
A.1mol H2燃烧放出的热量为H2的燃烧热
B.Na2SO3和H2O2的反应为氧化还原反应
C.![]() 和
和![]() 互为同系物
互为同系物
D.BaSO4的水溶液不导电,故BaSO4是弱电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com