
����Ŀ��������CO2����ƫ���������ЧӦ��Ҳ������彡�����Ӱ�죻CO2����;�㷺������ʹ����ɻ�����CO2�ۻ�������������ЧӦ��ʵ��CO2������ѭ����
��1��һ��������CO2���Ƶ�Na2CO3��NaHCO3�ȡ�
�������ʵ���Ũ�ȵ�Na2CO3��NaHCO3��Һ������ǰ��____���ߣ�����>����<������=������
���������������ʵ���Ũ�Ⱦ�Ϊ0.1mol/L�ĵ������Һ������ϡ����ͬ����ʱ������pH�仯������__������ĸ��ţ���
A��Na2CO3 |
B��NaHCO3 |
C��NaAlO2 |
D��CH3COONa |
E��NaOH
��2����֪��ӦFe(s)��CO2(g)![]() FeO(s)��CO(g) ��H��a kJ/mol������ڲ�ͬ�¶��£�
FeO(s)��CO(g) ��H��a kJ/mol������ڲ�ͬ�¶��£�
�÷�Ӧ��ƽ�ⳣ��K���¶ȵı仯���£�
�¶�(��) | 300 | 500 | 700 |
K | 3.00 | 3.47 | 4.40 |
������Ӧ��a_______0������>������<������=��)����2L�ܱ�������300���½��з�Ӧ����Fe��CO2����ʼ����Ϊ4 mol�����ﵽƽ��ʱCO2��ת����Ϊ________��
��3��Ŀǰ��ҵ�Ͽ�����CO2��H2��230�������������·�Ӧ���ɼ״�������ˮ��������ͼΪ��ѹ������0.5 mol CO2��1.5 mol H2��Ӧת���ʴ�80%ʱ�������仯ʾ��ͼ����÷�Ӧ���Ȼ�ѧ����ʽΪ__________��
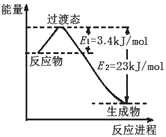
��4���˹���������ܹ�����̫���ܣ���CO2��H2O�Ʊ���ѧԭ�ϡ���ͼ���Ʊ�HCOOH��ʾ��ͼ������Ҫ��ش����⣺
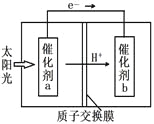
������b����ĵ缫��ӦʽΪ__________��
�����ⶨ����ÿ����ͨ�����ӽ���Ĥ��H+�����ʵ���Ϊ40mol����ÿСʱ�ɲ���O2_____kg��
���𰸡�> E > 75% CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ��H =��49 kJ/mol CO2+2e��+2H+=HCOOH 19.2
CH3OH(g)+H2O(g) ��H =��49 kJ/mol CO2+2e��+2H+=HCOOH 19.2
��������
��1���������ʵ���Ũ�ȵ�Na2CO3��NaHCO3��Һ��Na2CO3��ˮ��̶ȸ���Na2CO3��Һ�ļ��Խ�ǿ���ʼ���ǰ��>���ߣ�
��Na2CO3 ��NaHCO3��NaAlO2 ��CH3COONa����ǿ�������Σ�ϡ��ʱ��ٽ�ˮ�⣬������Һ�ļ��Ա仯��С��NaOH��ȫ���룬ϡ��ʱ���Ա仯���ѡE��
��2���ӱ��п����������¶ȵ�����ƽ�ⳣ�����������¶�ƽ��������Ӧ�����ƶ���������Ӧ���������ȷ�Ӧ����a>0��Fe��CO2����ʼ����Ϊ4 mol����CO2����ʵŨ��Ϊ2mol/L����CO2��Ӧ��x mol/L�����ݷ�Ӧ����ʽ�����У�
Fe(s)��CO2(g)![]() FeO(s)��CO(g)
FeO(s)��CO(g)
c����ʼ��mol/L 2 0
c���仯��mol/L x x
c��ƽ�⣩mol/L 2-x x
K=c(CO)/ c(CO2)= x/(2-x)=3���ã�x=1.5 mol/L��CO2��ת����Ϊ��1.5 mol��L/2 mol/L=0.75 =75%��
��3����ͼ������Ӧ�������������������������ʷ�Ӧ�Ƿ��ȷ�Ӧ���ٸ��������ı仯ͼ��֪��0.5 mol CO2��1.5 mol H2��Ӧת���ʴ�80%ʱ����Ϊ��19.6 kJ����ô1mol CO2��3mol H2��Ӧ�ų�����Ϊ49kJ�����Ȼ�ѧ����ʽΪ��CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ��H =��49 kJ/mol��
CH3OH(g)+H2O(g) ��H =��49 kJ/mol��
��4�������ݵ��ӵ��ƶ�����֪��b������������������ԭ��Ӧ��Ԫ�صĻ��ϼ۽��ͣ�CO2��������Ӧ����HCOOH���缫��ӦΪ��CO2+2e��+2H+=HCOOH��
������2O2-��O2��ת�Ƶĵ���Ϊ4e-����ÿ����ͨ�����ӽ���Ĥ��H+�����ʵ���Ϊ40mol����ôת�Ƶĵ���ҲΪ40mol���������O2�����ʵ���Ϊ10mol��һСʱ��������600mol������Ϊ��600mol��32g/mol=19200g= 19.2 kg��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС������ͼ��ʾװ��̽������п��ϡ����ķ�Ӧ��ʵ������е�������ָ�뷢��ƫת����ش��������⣺
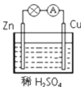
(1)пƬ����ص�__________������������������ĵ缫��Ӧʽ��__________��
(2)ͭƬ��������__________�������ĵ缫��Ӧʽ��__________��
(3)����ϡH2SO4����CuSO4����������ӦʽΪ��__________��
(4)�����缫������Ƭ��ͭƬ������__________�����Ƭ��ͭƬ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���� ( ����)
A.�����(![]() )������̼ԭ�Ӳ�ȫ��ͬһƽ����
)������̼ԭ�Ӳ�ȫ��ͬһƽ����
B.��ϩ���Ҵ�����ʹ����KMnO4��Һ��ɫ
C.![]() ��
��![]() ��Ϊͬ���칹�壬�Ҷ��ȴ����Ϊ6��
��Ϊͬ���칹�壬�Ҷ��ȴ����Ϊ6��
D.���������������������Ӧ����ȡ����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʵ�����Ʊ�K2FeO4��ʵ��װ��ͼ�����м�Ϊ��������װ�á������ϣ�K2FeO4Ϊ��ɫ���壬����KOH������ǿ�����ԣ�
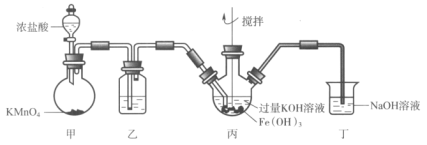
����˵������ȷ���ǣ� ��
A.���������Լ�Ϊ����ʳ��ˮ
B.���Ͷ��о��ᷢ����Ӧ��Cl2+2OH-=Cl-+ClO-+H2O
C.���в�����ɫ���壬˵�����������£�Cl2������ǿ��K2FeO4
D.��ȡ��Ӧ�������ɫ��Һ������ϡ�������Cl2����֤����K2FeO4����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.��һѧ����ʵ���Ҳ�ij��Һ��pH��ʵ��ʱ������������ˮ��ʪpH��ֽ��Ȼ���ýྻ����IJ�����պȡ�������м�⡣
(1)��ѧ���IJ���___(������ȷ������������)����������___________��
(2)�ò����Ƿ�һ�������?______________________��
(3)���ô˷����ֱ�ⶨc(OH-)��ȵ�����������Һ�Ͱ�ˮ��pH�����ϴ����____��ԭ����___��
(4)ֻ�������Լ���ѡ��ʵ��������Լ������ܷ�����0.1mol��L-1������Һ��0.01mol��L-1������Һ��____����������������____________________________��
�Լ���A.��ɫʯ����Һ��B.��̪��Һ��C.������Һ��D.����ˮ��E.�Ȼ�����Һ��F.pH��ֽ
��.pH=2��A��B��������Һ��1mL���ֱ��ˮϡ�͵�1000mL����pH����Һ����Ĺ�ϵ��ͼ��ʾ��
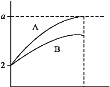
�ش�����������
(1)��a=5����AΪ___����BΪ___��(����ǿ����������)������ϡ��100������A��pH___7(����<����>������=��)��
(2)��A��B������������a�ķ�Χ��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л����������ȷ���ǣ� ��
A.����Ķ�±������4�֣�������±������2��
B.ij����ͬ���칹��ֻ���γ�һ��һ�ȴ�������ʽһ��ΪC5H12
C.�ױ������ϵ�һ����ԭ�ӱ���3��̼ԭ�ӵ����ȡ�������ò�����6��
D.�Զ��ױ��ĺ˴Ź���������ʾ��3�ֲ�ͬ��ѧ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1��2����������������Ϳ����������Ӽ���������������ɫҺ�壬�ܶ���2.18g/cm3���е�131.4�����۵�9.79����������ˮ�������ڴ����ѡ���ͪ���л��ܼ�����ʵ���п�������ͼ��ʾװ���Ʊ�1��2���������������з�Һ©������ƿa��װ���Ҵ���Ũ����Ļ��Һ���Թ�d��װ��Ũ��ˮ�����渲������ˮ����
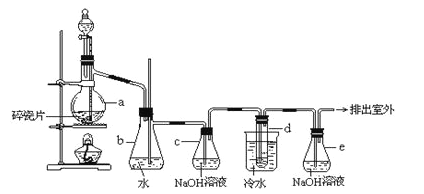
����д���пհף�
��1����ƿa�з��������Ҵ�����ˮ��Ӧ������ȥ��Ӧ����Ӧ�¶���170�������Ҹ÷�ӦҪ���¶�Ѹ�����ߵ�170������������������Ӧ����д���Ҵ�������ȥ��Ӧ�ķ���ʽ ��
��2��д���Ʊ�1��2����������Ļ�ѧ����ʽ�� ��
��3����ȫƿb���Է�ֹ�����������Լ��ʵ�����ʱ�Թ�d�Ƿ�����������ش�������ʱƿb�е����� ��
��4������c��NaOH��Һ�������ǣ� ��
��5���жϸ��Ʊ���Ӧ�Ѿ��������������___________________________��
��6�������������������������ѣ�����__________�ķ�����ȥ��
��7����Ӧ������Ӧ����ˮ��ȴװ��d������ҪĿ����___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�̼���������Ԫ�ػ���������ʻ�ת���Խ�����̬�����������й�������Ҫ����.
(1)��ˮ����̼�Ĵ�����ʽ���ֲ�����ͼ��ʾ��
�����ӷ���ʽ��ʾ��ˮ�������Ե�ԭ��______________.��֪������ˮpH=8.1��Ԥ���ļ���ˮ���Խ���_____________(��д����ǿ������������)��������_________________________.
(2)��ҵ����CO��H2Ϊԭ�Ϻϳɼ״��ķ�Ӧ��CO(g)+2H2(g)CH3OH(g) ��H<0�����ݻ�Ϊ1L�ĺ��������У��ֱ���T1��T2��T3�����¶��ºϳɼ״�.��ͼ�����������¶��²�ͬH2��CO����ʼ��ɱ�(��ʼʱCO�����ʵ�����Ϊ1mol)��COƽ��ת���ʵĹ�ϵ.����˵����ȷ����_______________.
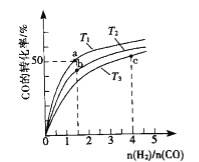
A.a��b��c����H2ת���ʣ�c>a>b
B.���������¶�֮���ϵΪT1>T2>T3
C.a��״̬����ͨ��0.5 mol co��0.5 mol CH3OH��ƽ�ⲻ�ƶ�
D.c��״̬����ͨ��1 mol co��4mol H2����ƽ����H2�������������
(3)NO���ٳ����㱻�ƻ����䷴Ӧ������ͼ��ʾ��
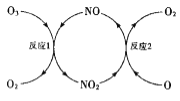
��NO��������___________________��
����֪:O3(g)+0(g)=202(g) ��H=-143kJ��mol-l
��Ӧ1: O3(g)+NO(g)NO2(g)+O2(g) ��H1=-200.2kJ��mol-l
��Ӧ2���Ȼ�ѧ����ʽΪ_____________________��
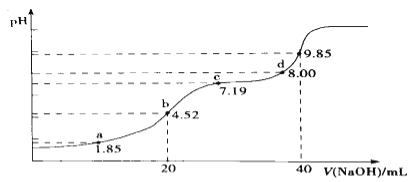
(4)������Ⱦ��SO2����NaOH����.��֪pKa=-lgKa,25��ʱ��H2SO3��pKa1=1.85��pKa2=7.19�����¶�����0.1mol�� L-1 NaOH��Һ�ζ�20mL0.1mol��L-1H2SO3��Һ�ĵζ�������ͼ��ʾ.b��������Һ�и�����Ũ���ɴ�С��˳����________________��c��������Һ�У�c(Na+)___________3c(HSO3-)(����>������<������=��).
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������a��b��c��ʾ��Ӧ�����м�����Լ���������ͼ��ʾװ����ȡ���������ռ���������(����)
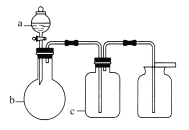
ѡ�� | ���� | a | b | c |
A | NH3 | Ũ��ˮ | ��ʯ�� | ��ʯ�� |
B | SO2 | 70%��ŨH2SO4 | Na2SO3���� | 98%��ŨH2SO4 |
C | NO | ϡHNO3 | ͭм | H2O |
D | NO2 | ŨHNO3 | ͭм | NaOH��Һ |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com