
【题目】表中a、b、c表示相应仪器中加入的试剂,可用如图所示装置制取、净化、收集的气体是( )
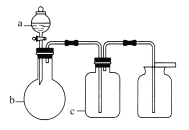
选项 | 气体 | a | b | c |
A | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
B | SO2 | 70%的浓H2SO4 | Na2SO3固体 | 98%的浓H2SO4 |
C | NO | 稀HNO3 | 铜屑 | H2O |
D | NO2 | 浓HNO3 | 铜屑 | NaOH溶液 |
A.AB.BC.CD.D
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】空气中CO2含量偏高会产生温室效应,也会对人体健康造成影响;CO2的用途广泛,合理使用则可缓解由CO2累积所产生的温室效应,实现CO2的良性循环。
(1)一定条件下CO2可制得Na2CO3、NaHCO3等。
①等物质的量浓度的Na2CO3、NaHCO3溶液,碱性前者____后者(填“>”“<”或“=”)。
②有下列五种物质的量浓度均为0.1mol/L的电解质溶液,将其稀释相同倍数时,其中pH变化最大的是__(填字母编号)。
A.Na2CO3 |
B.NaHCO3 |
C.NaAlO2 |
D.CH3COONa |
E.NaOH
(2)已知反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH=a kJ/mol,测得在不同温度下,
FeO(s)+CO(g) ΔH=a kJ/mol,测得在不同温度下,
该反应的平衡常数K随温度的变化如下:
温度(℃) | 300 | 500 | 700 |
K | 3.00 | 3.47 | 4.40 |
上述反应中a_______0(填“>”、“<”或“=”);在2L密闭容器中300℃下进行反应,若Fe和CO2的起始量均为4 mol,当达到平衡时CO2的转化率为________。
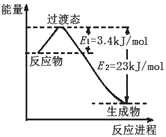
(3)目前工业上可以用CO2和H2在230℃、催化剂条件下反应生成甲醇蒸汽和水蒸气。下图为恒压容器中0.5 mol CO2和1.5 mol H2反应转化率达80%时的能量变化示意图。则该反应的热化学方程式为__________。
(4)人工光合作用能够借助太阳能,用CO2和H2O制备化学原料。下图是制备HCOOH的示意图,根据要求回答问题:
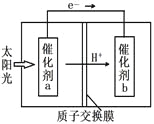
①催化剂b表面的电极反应式为__________。
②经测定,若每分钟通过质子交换膜的H+的物质的量为40mol,则每小时可产生O2_____kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示。请回答:

(1)醋酸的电离平衡常数表达式为:__________________________。
(2)a、b、c三点c(H+)由大到小的顺序是________________________________________。
(3)a、b、c三点中醋酸的电离程度最大的点是________点。
(4)若使c点溶液中的c(CH3COO-)提高,可采取的措施是________(填标号)。
A.加热 B.加很稀的NaOH溶液 C.加固体KOH D.加水 E.加固体CH3COONa F.加锌粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一定量的镁铝合金与![]() 稀硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入
稀硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入![]() NaOH溶液,加入NaOH溶液的体积与产生沉淀的物质的量的关系如图所示。下列说法 不正确的是
NaOH溶液,加入NaOH溶液的体积与产生沉淀的物质的量的关系如图所示。下列说法 不正确的是
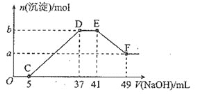
A.![]()
B.OC段反应的离子方程式为![]()
C.D点对应溶液中的溶质为![]() 和
和![]()
D.原![]() 溶液中溶质的物质的量浓度为
溶液中溶质的物质的量浓度为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去)。化合物B在常温常压下为气体,B和C的相对分子质量之比为4∶5,化合物D是重要的工业原料。
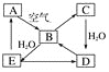
(1)写出B与足量硝酸钡溶液反应的离子方程式:___________。
(2)写出E与A的氢化物反应生成A的化学方程式:________。
(3)将5 mL 0.10 mol·L-1的E溶液与10 mL 0.10 mol·L-1的NaOH溶液混合。反应后溶液的pH______7(填“大于”、“小于”或“等于”),理由用离子方程式表示_______________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物种类繁多,无处不在:
(1)白蚁信息素![]() 用系统命名法命名___;
用系统命名法命名___;
(2)人造羊毛的结构为![]() ,则合成人造羊毛的单体是___;
,则合成人造羊毛的单体是___;
(3)丙醛是一种精细化工原料,写出丙醛与银氨溶液反应的化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三硫化四磷用于制造火柴等,可由白磷和单质硫化合而得。它们的结构如下:

依据下列键能数据,反应8P4(s)+3S8(s)=8P4S3(g)的ΔH为( )
化学键 | P—P | S—S | P—S |
键能/kJ·mol-1 | a | b | c |
A.24(a+b-2c) kJ·mol-1B.(32a+24b-24c) kJ·mol-1
C.(48c-24a-24b) kJ·mol-1D.(8a+3b-3c) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用碱性丙烷燃料电池电解苦卤水![]() 含
含![]() 、
、![]() 、
、![]() 、
、![]() 的装置如图所示
的装置如图所示![]() 、b为石墨电极
、b为石墨电极![]() ,下列说法正确的是( )
,下列说法正确的是( )
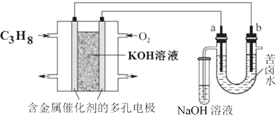
A.电池工作时,负极反应式为:![]()
B.电解时,a电极周围首先放电的是![]() 而不是
而不是![]() ,说明当其他条件相同时后者的还原性强于前者
,说明当其他条件相同时后者的还原性强于前者
C.电解时,电子流动的路径是:负极![]() 外电路
外电路![]() 阴极
阴极![]() 溶液
溶液![]() 阳极
阳极![]() 正极
正极
D.忽略能量损耗,当电池中消耗16gO2时,a极周围会产生0.71gCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气污染越来越成为人们关注的问题,烟气中的NOx必须脱除(即脱硝)之后才能排放。
(1)CO和H2可作为能源和化工原料,应用十分广泛。 反应CO(g)+H2O(g) ![]() H2(g)+CO2(g)的平衡常数随温度的变化如表所示。
H2(g)+CO2(g)的平衡常数随温度的变化如表所示。
温度/℃ | 400 | 500 | 830 | 1 000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
①从上表可以推断:此反应是__________(填“吸”或“放”)热反应。
②在830 ℃下,若开始时向恒容密闭容器中充入CO与H2O均为1 mol,则达到平衡后CO的转化率为________。
(2)在汽车尾气系统中装置催化转化器,可有效降低NOx和CO的排放。
已知:①2CO(g)+O2(g) ![]() 2CO2(g) ΔH=566.0 kJ·mol1
2CO2(g) ΔH=566.0 kJ·mol1
②N2(g)+O2(g) ![]() 2NO(g) ΔH=+180.0 kJ·mol1
2NO(g) ΔH=+180.0 kJ·mol1
③2NO(g)+O2(g) ![]() 2NO2(g) ΔH=116.5 kJ·mol1
2NO2(g) ΔH=116.5 kJ·mol1
回答下列问题:
①CO的燃烧热为 _________。若1 mol N2(g)、1 mol O2(g) 分子中化学键断裂时分别需要吸收946 kJ、498 kJ的能量,则1 mol NO(g) 分子中化学键断裂时需吸收的能量为_________kJ。
②写出CO将NO2还原为单质反应的热化学方程式为 ____________________
(3)汽车排气管上的催化转化器,发生上述的CO将NO2还原为单质反应。在一定温度下,将一定量的CO和NO2充入2L固定容积的容器中,回答以下问题:
①能说明该反应达到平衡状态的是_____________(填字母标号)。
A.2υ正(NO2)=υ逆(N2)
B. 混合气体的平均相对分子质量保持不变
C.气体总压强不再变化
D. ΔH保持不变
E.混合气体的密度不再变化
②从反应开始到5min,生成了0.08mol N2,则5min内υ(CO)=___molL1min1。
③25min时,物质浓度变化如图所示,则改变的条件可能是___________(填字母标号)。
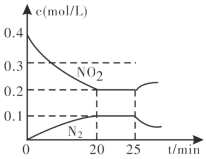
A.缩小容器体积
B.增加NO2的浓度
C.降低温度
D.升高温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com