
【题目】下图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去)。化合物B在常温常压下为气体,B和C的相对分子质量之比为4∶5,化合物D是重要的工业原料。
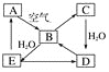
(1)写出B与足量硝酸钡溶液反应的离子方程式:___________。
(2)写出E与A的氢化物反应生成A的化学方程式:________。
(3)将5 mL 0.10 mol·L-1的E溶液与10 mL 0.10 mol·L-1的NaOH溶液混合。反应后溶液的pH______7(填“大于”、“小于”或“等于”),理由用离子方程式表示_______________;
【答案】3SO2 +2H2O +3Ba2++2NO3- =2NO↑+3BaSO4↓+4H+ H2SO3+2H2S=3S↓+3H2O 大于 SO32-+ H2O![]() HSO3-+OH-
HSO3-+OH-
【解析】
固态单质A能与空气中的氧气反应生成气体物质B,则A可能为C或S等,假定为S,则B为SO2,C为SO3,它们的相对分子质量为64:80=4:5,恰好与题意相符(同时也证明A不是C),则D为H2SO4,它是一种重要的工业原料,与题意也相符,进一步证明A为S,E为H2SO3,结合物质的性质以及题目要求可解答该题。
(1)B为SO2,与足量硝酸钡反应会被氧化成硫酸根,继而生成硫酸钡沉淀,
故答案为:3SO2 +2H2O +3Ba2++2NO3- =2NO↑+3BaSO4↓+4H+;
(2)H2SO3与H2S反应生成S,反应的方程式为H2SO3+2H2S═3S↓+3H2O,故答案为:H2SO3+2H2S═3S↓+3H2O;
(3)反应生成Na2SO3,为强碱弱酸盐,水解呈碱性,溶液pH>7,
故答案为:大于;SO32-+ H2O![]() HSO3-+OH-;
HSO3-+OH-;


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.有一学生在实验室测某溶液的pH,实验时,他先用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒蘸取试样进行检测。
(1)该学生的操作___(填“正确”或“错误”),其理由是___________;
(2)该操作是否一定有误差?______________________;
(3)若用此方法分别测定c(OH-)相等的氢氧化钠溶液和氨水的pH,误差较大的是____,原因是___;
(4)只从下列试剂中选择实验所需的试剂,你能否区分0.1mol·L-1硫酸溶液和0.01mol·L-1硫酸溶液?____,简述操作过程:____________________________。
试剂:A.紫色石蕊溶液 B.酚酞溶液 C.甲基橙溶液 D.蒸馏水 E.氯化钡溶液 F.pH试纸
Ⅱ.pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其pH与溶液体积的关系如图所示。
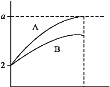
回答下列问题:
(1)若a=5,则A为___酸,B为___酸(填“强”或“弱”),若再稀释100倍,则A的pH___7(填“<”“>”或“=”)。
(2)若A、B都是弱酸,则a的范围是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作对应的现象不符合事实的是
选项 | 实验操作 | 现象 |
A | 向盛有 | 溶液逐渐变为黄色,滴加KSCN后溶液变血红色 |
B | 向盛有 | 溶液逐渐褪色,静置后观察到溶液有分层现象 |
C | 向 | 先产生白色沉淀,后沉淀消失 |
D | 向盛有 | 有刺激性气味气体产生,溶液变浑浊 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示实验合理的是
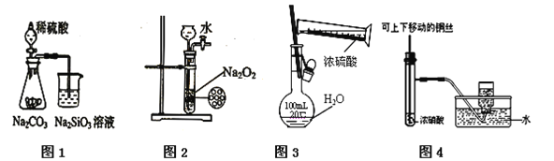
A. 图1为证明非金属性强弱:S > C > Si
B. 图2为制备少量氧气
C. 图3为配制一定物质的量浓度的硫酸溶液
D. 图4为制备并收集少量NO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表所示为部分短周期元素的原子半径及主要化合价,根据表中信息判断下列叙述不正确的
元素代号 | A | B | C | D | E | N | G |
原子半径 |
|
|
|
|
|
|
|
主要化合价 |
|
|
|
|
|
|
|
A.稳定性:HG>HN;熔沸点:HG>HN
B.工业上常用电解熔融DN3的方法冶炼D单质
C.B、C原子的最外层子电子数相同
D.![]() 的最高价氧化物的水化物溶液的pH:
的最高价氧化物的水化物溶液的pH:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表中a、b、c表示相应仪器中加入的试剂,可用如图所示装置制取、净化、收集的气体是( )
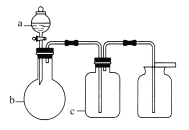
选项 | 气体 | a | b | c |
A | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
B | SO2 | 70%的浓H2SO4 | Na2SO3固体 | 98%的浓H2SO4 |
C | NO | 稀HNO3 | 铜屑 | H2O |
D | NO2 | 浓HNO3 | 铜屑 | NaOH溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫是大气的主要污染物之一。催化还原SO2不仅可以消除SO2的污染,还可以得到工业原料S。燃煤烟气中硫的回收反应为:2CO(g)+SO2(g) ![]() 2CO2(g)+S(l) △H。
2CO2(g)+S(l) △H。
(1)已知:2CO(g)+O2(g)===2CO2(g) △H1=-566.0kJ·mol-1
S(l)+O2(g)===SO2(g) △H2=-296.8 kJ·mol-1
则硫的回收反应的△H=___________ kJ·mol-1。
(2)其他条件相同、催化剂不同时,硫的回收反应中SO2的转化率随反应温度的变化如图所示。260℃时,___________(填“La2O3”、“NiO”或“TiO2”)的催化效率最高。La2O3和NiO作催化剂均可能使SO2的转化率达到很高,不考虑价格因素,选择La2O3的主要优点是___________。

(3)一定条件下,若在恒压密闭容器中发生硫的回收反应,SO2的平衡转化率与温度、压强的关系如图所示,则P1、P2、P3、P4由大到小的顺序为___________;某温度下,若在恒容密闭容器中,初始时c(CO)=2 a mol·L-1,c(SO2)= a mol·L-1,SO2的平衡转化率为80%,则该温度下反应的化学平衡常数为___________。
(4)某实验小组为探究烟气流速、温度对该反应的影响,用La2O3作催化剂,分别在两种不同烟气流量、不同温度下进行实验。实验结果显示:在260℃时,SO2的转化率随烟气流量增大而减小,其原因是___________;在380℃时,SO2的转化率随烟气流量增大而增大,其原因是___________。
(5)工业上常用Na2SO3溶液吸收烟气中的SO2,将烟气通入1.0 mol·L-1的N2SO3溶液,当溶液pH约为6时,吸收SO2的能力显著下降此时溶液中c(HSO3-)c︰(SO32-)=___________。(已知H2SO3的Ka1=1.5×10-2、Ka2=1.0×10-7)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁在热的稀![]() 中反应,其主要还原产物为
中反应,其主要还原产物为![]() ,而在冷的稀
,而在冷的稀![]() 中反应,其主要还原产物为NO,当溶液更稀时,其还原产物为
中反应,其主要还原产物为NO,当溶液更稀时,其还原产物为![]() 。请分析如图,回答有关问题。
。请分析如图,回答有关问题。
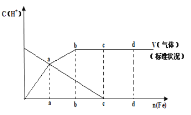
![]() 假设在任一气体产生的曲线段内只有一种还原产物,试配平由b点到c点时的化学反应方程式:_____Fe+____HNO3—____Fe(NO3)3+_________+____H2O
假设在任一气体产生的曲线段内只有一种还原产物,试配平由b点到c点时的化学反应方程式:_____Fe+____HNO3—____Fe(NO3)3+_________+____H2O
![]() 判断从o点到a点时的还原产物,应是___________
判断从o点到a点时的还原产物,应是___________
![]() 点到b点时产生还原产物为_________,其原因是______________
点到b点时产生还原产物为_________,其原因是______________
![]() 已知达到d点时反应完全结束,此时溶液中的主要阳离子为____________。
已知达到d点时反应完全结束,此时溶液中的主要阳离子为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设nA为阿伏加德罗常数的数值,下列叙述正确的是
A.1molL-1 MgCl2溶液中的Mg2+数为NA
B.1 mol Na2O2固体中含阴离子总数为2NA
C.5 g质量分数为46%的乙醇溶液中,氢原子的总数为0.6 NA
D.100 mL 12molL-1浓盐酸与足量MnO2加热反应,转移电子数为1.2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com