
【题目】下表所示为部分短周期元素的原子半径及主要化合价,根据表中信息判断下列叙述不正确的
元素代号 | A | B | C | D | E | N | G |
原子半径 |
|
|
|
|
|
|
|
主要化合价 |
|
|
|
|
|
|
|
A.稳定性:HG>HN;熔沸点:HG>HN
B.工业上常用电解熔融DN3的方法冶炼D单质
C.B、C原子的最外层子电子数相同
D.![]() 的最高价氧化物的水化物溶液的pH:
的最高价氧化物的水化物溶液的pH:![]()
【答案】B
【解析】
各元素均为短周期元素,E的化合价为![]() 、
、![]() ,则E为S元素;A的原子半径大于S,化合价为
,则E为S元素;A的原子半径大于S,化合价为![]() ,则A为Na元素;N、G的主要化合价都为
,则A为Na元素;N、G的主要化合价都为![]() ,说明二者位于ⅤⅡA族,根据原子半径可知,N为Cl、G为F元素;D的化合价为
,说明二者位于ⅤⅡA族,根据原子半径可知,N为Cl、G为F元素;D的化合价为![]() ,原子半径大于Cl元素,则D为Al元素;B、C的化合价都为
,原子半径大于Cl元素,则D为Al元素;B、C的化合价都为![]() ,根据原子半径
,根据原子半径![]() 可知,B为Mg元素,C为Be元素,据此结合元素周期律知识解答。
可知,B为Mg元素,C为Be元素,据此结合元素周期律知识解答。
A. 非金属性越强,对应气态氢化物的稳定性越强,则非金属性:![]() ,则气态氢化物的稳定性:
,则气态氢化物的稳定性:![]() ;由于HF能形成分子间氢键,使沸点反常的升高,熔沸点
;由于HF能形成分子间氢键,使沸点反常的升高,熔沸点![]() ,故A正确;
,故A正确;
B. 氯化铝为共价化合物,工业上用电解熔融的氧化铝的方法而不是氯化铝来制备金属铝,故B错误;
C. B为Mg元素,C为Be元素,最外层电子数相同,故价电子数相等,故C正确;
D. A的最高价氧化物的水化物为氢氧化钠,N为高氯酸,相同浓度时两者的pH不等,故D正确;
故选B。


科目:高中化学 来源: 题型:
【题目】按要求完成下列空格
Ⅰ.为减少SO2的排放,常采取以下措施,将煤转化为清洁的气体燃料。已知:
①H2(g)+![]() O2(g)=H2O(g) ΔH1=-241.8kJ·mol-1
O2(g)=H2O(g) ΔH1=-241.8kJ·mol-1
②C(s)+![]() O2(g)=CO(g) ΔH2=-110.5kJ·mol-1
O2(g)=CO(g) ΔH2=-110.5kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式____________。
Ⅱ.将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g) +B(g) ![]() xC(g) +2D(g),经5min后,测得D的浓度为0.5molL﹣1,C的平均反应速率是0.1mol/(Lmin),且此时A的物质的量浓度为0.25molL﹣1。
xC(g) +2D(g),经5min后,测得D的浓度为0.5molL﹣1,C的平均反应速率是0.1mol/(Lmin),且此时A的物质的量浓度为0.25molL﹣1。
(1)x的值是_____;
(2)B的平均反应速率_____;
(3)则反应开始前放入容器中A的物质的量_____。
Ⅲ.(1)CO2,NaCl,Na,Si,CS2,五种物质的熔点由高到低的顺序是________(用分子式或化学式表示)。
(2)A、B、C、D为四种晶体,性质如下:
A固态时能导电,能溶于盐酸;B能溶于CS2,不溶于水;
C固态时不导电,液态时能导电,可溶于水;D固态、液态时均不导电,熔点为3500 ℃;
试推断它们的晶体类型:A_____;B_____;C_____;D_____。
(3)磷和氯气反应可生成组成比为1∶3的化合物,该化合物的立体构型为_____,中心原子的杂化轨道类型为_____,中心原子的价层电子对数为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将煤直接作为燃料燃烧,不但热效率较低,且产生烟尘、二氧化硫、氮氧化物等物质,造成严重的环境污染。煤的干馏是提高煤的利用率、生产重要化工原料、绣像污染物排放量的有效措施之一。某化学学习小组在实验室条件下探究煤干馏的现象及产物,装置如图所示,请回答有关问题:
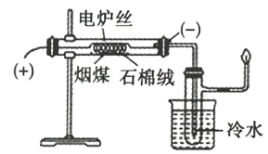
(1)煤干馏的条件是___。
(2)盛有冷水的烧杯的作用是___。
(3)实验后检验有粗氨水生成的操作是___。
(4)已知CO不能使溴水退色,若将从具支试管支管口处逸出的气体通入溴水中,发现溴水退色,则说明煤的干馏产生了___。
(5)从煤焦油中分离出苯、甲苯、二甲苯的实验方法是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔(C2H2)在气焊、气割及有机合成中用途非常广泛,可由电石(CaC2)直接水化法或甲烷在1500℃左右气相裂解法生产。
(1)电石水化法制乙炔是将生石灰与焦炭在3000℃下反应生成CaC2,CaC2再与水反应即得到乙炔。CaC2与水反应的化学方程式为____
(2)已知:CH4(g)+2O2(g)===CO2(g)+2H2O(1) △H1=-890.3kJ/mol
C2H2(g)+2.50(g)===2CO2(g)+H2O(1) △H2=-1299.6J/mol
2H2(g)+O2(g)=2H2O(1) △H3=-571.6kJ/mol
则甲烷气相裂解反应:2CH4(g)===C2H2(g)+3H2(g)的△H=_____kJ/mol。
(3)哈斯特研究得出当甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)的关系如图所示。
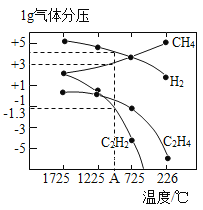
①T1℃时,向1L恒容密闭容器中充入0.3 mol CH4只发生反应2CH4(g)![]() C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=c(CH4)。该反应的△H____0(填“>”或“<”),CH4的平衡转化率为____%(保留3位有效数字)。上述平衡状态某一时刻,若改变温度至T2℃,CH4以0.01mol/(L·s)的平均速率增多,经ts后再次达到平衡,平衡时,c(CH4)=2c(C2H4),则T1_____(填“>”或“<”)T2,t=______s。
C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=c(CH4)。该反应的△H____0(填“>”或“<”),CH4的平衡转化率为____%(保留3位有效数字)。上述平衡状态某一时刻,若改变温度至T2℃,CH4以0.01mol/(L·s)的平均速率增多,经ts后再次达到平衡,平衡时,c(CH4)=2c(C2H4),则T1_____(填“>”或“<”)T2,t=______s。
②列式计算反应2CH4(g)![]() C2H2(g)+3H2(g)在图中A点温度时的平衡常数K=____(用平衡分压代替平衡浓度计算,lg0.05=-1.3)。
C2H2(g)+3H2(g)在图中A点温度时的平衡常数K=____(用平衡分压代替平衡浓度计算,lg0.05=-1.3)。
③由图可知,甲烷裂解制乙炔有副产物乙烯生成,为提高甲烷制乙炔的转化率,除改变温度外,还可采取的措施有___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用右图所示装置进行下列实验,能得出相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 | 实验装置 |
A | 稀硫酸 | Na2S | AgNO3与AgCl的溶液 | Ksp(AgCl)>Ksp(Ag2S) |
|
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2 溶液 | SO2与可溶性钡盐均可以生成白色沉淀 | |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去)。化合物B在常温常压下为气体,B和C的相对分子质量之比为4∶5,化合物D是重要的工业原料。
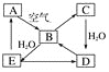
(1)写出B与足量硝酸钡溶液反应的离子方程式:___________。
(2)写出E与A的氢化物反应生成A的化学方程式:________。
(3)将5 mL 0.10 mol·L-1的E溶液与10 mL 0.10 mol·L-1的NaOH溶液混合。反应后溶液的pH______7(填“大于”、“小于”或“等于”),理由用离子方程式表示_______________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液![]() ,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解
,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解![]() 。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示
。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示![]() 已知硝酸只被还原为NO气体
已知硝酸只被还原为NO气体![]() 。下列分析或结果错误的是
。下列分析或结果错误的是![]()
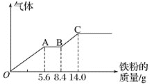
A.原混合酸中![]() 物质的量为
物质的量为![]()
B.OA段产生的是NO,AB段的反应为![]() ,BC段产生氢气
,BC段产生氢气
C.第二份溶液中最终溶质为![]()
D.![]() 浓度为
浓度为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个绝热定容的密闭容器中,1molA 与 2molB 发生反应 A(g)+2B(g) ![]() xC(g)+2D(g) △H=bkJ·mol1(b<0),下列说法正确的是
xC(g)+2D(g) △H=bkJ·mol1(b<0),下列说法正确的是
A. 充分反应后,放出热量为 b kJ
B. 若 x=1,容器中压强不变时不能判断反应达到平衡
C. 当 B 和 D 的物质的量为 1:1 时,表明该反应已达到平衡
D. 达到平衡过程中,正反应速率可能是先增大再减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析如图所示的四个原电池装置,其中结论正确的是
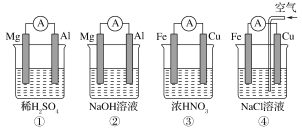
A. ①②中Mg作负极,③④中Fe作负极
B. ②中Mg作正极,正极反应式为6H2O+6e-==6OH-+3H2↑
C. ③中Fe作负极,电极反应式为Fe-2e-==Fe2+
D. ④中Cu作正极,电极反应式为2H++2e-==H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com