
【题目】(Ⅰ)工业上通常采用CO(g)和H2(g)催化合成甲醇CH3OH(g)。
(1)已知在某温度和压强下:
①2CO(g)+O2(g)=2CO2(g) △H= -566.0 kJ·mol-1
②2H2(g)+O2(g)=2H2O(g) △H= - 483.6 kJ·mol-1
③2CH3 OH(g)+3O2(g)=2CO2(g)+4H2 O(g) △H= -1275.6 kJ·mol-1
则在相同的温度和压强下,CO(g)与H2(g)合成CH3OH(g)的热化学方程式是_________________________________________________________。
(2)某化学研究性学习小组模拟工业合成甲醇的反应,在容积固定为2L的密闭容器内充入1 molCO和 2 molH2,加入合适催化剂(体积可以忽略不计)后在250°C开始反应,甲醇的物质的量的变化如下:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
甲醇/mol | 0 | 0.22 | 0.36 | 0.45 | 0.5 | 0.5 |
则从反应开始到20min时,以CO表示的平均反应速率=_________________,该温度下平衡
常数K=________________,若升高温度则K值__________(填“增大”、“减小”或“不变”);
(3)下列描述中能说明上述反应已达平衡的是________________;
A.2 v (H2)正= v (CH3OH)逆 B.容器内气体的平均摩尔质量保持不变
C.容器中气体的压强保持不变 D.单位时间内生成 n molCO 的同时生成 2n molH2
(Ⅱ)回答下列问题:
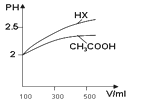
(1)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则Ka(HX) ______ Ka(CH3COOH)(填>、<或=)
(2)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中C(CH3COO)- c(Na+)=________mol·L-1(填精确值)。
【答案】 CO(g)+2H2(g) ![]() CH3OH(g) △H= -128.8 KJ/mol 0.0125mol/(L·min) 4 (mol/L)-2 减小 B C > 9.9×10-7
CH3OH(g) △H= -128.8 KJ/mol 0.0125mol/(L·min) 4 (mol/L)-2 减小 B C > 9.9×10-7
【解析】试题分析:(Ⅰ)(1)根据盖斯定律书写CO(g)与H2(g)合成CH3OH(g)的热化学方程式;(2)根据![]() 计算反应速率;利用“三段式”计算平衡常数;正反应放热,升高温度平衡逆向移动;(3)根据化学平衡特征分析;(Ⅱ)(1)酸性越弱稀释相同倍数PH变化越小;(2)根据电荷守恒计算;
计算反应速率;利用“三段式”计算平衡常数;正反应放热,升高温度平衡逆向移动;(3)根据化学平衡特征分析;(Ⅱ)(1)酸性越弱稀释相同倍数PH变化越小;(2)根据电荷守恒计算;
解析:(Ⅰ)(1)①2CO(g)+O2(g)=2CO2(g) △H= -566.0 kJ·mol-1
②2H2(g)+O2(g)=2H2O(g) △H= - 483.6 kJ·mol-1
③2CH3 OH(g)+3O2(g)=2CO2(g)+4H2 O(g) △H= -1275.6 kJ·mol-1
根据盖斯定律①![]() +②-③
+②-③![]() 得 CO(g)+2H2(g)
得 CO(g)+2H2(g) ![]() CH3OH(g) △H= -128.8 KJ/mol;
CH3OH(g) △H= -128.8 KJ/mol;
(2)
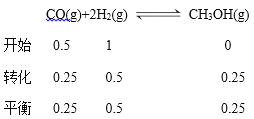
根据图表数据,20min时甲醇的浓度为0.25mol/L,则消耗CO的浓度是0.25mol/L,v(CO)= ![]() 0.0125mol/(L·min);平衡常数K=
0.0125mol/(L·min);平衡常数K=  ;正反应放热,升高温度平衡逆向移动,平衡常数减小;
;正反应放热,升高温度平衡逆向移动,平衡常数减小;
(3)A.平衡状态时,正逆反应速率比等于系数比,2 v (H2)正= v (CH3OH)逆时正逆反应速率比不等于系数比,所以不是平衡状态; B.根据质量守恒定律气体质量不变,气体物质的量是变量,根据 ,平均摩尔质量是变量,容器内气体的平均摩尔质量保持不变一定平衡;C.容器体积不变、容器内气体的物质的量是变量,所以压强是变量,容器中气体的压强保持不变一定平衡; D.单位时间内生成 n molCO 的同时生成 2n molH2,都是表示逆反应速率,反应不一定平衡。故选BC;
,平均摩尔质量是变量,容器内气体的平均摩尔质量保持不变一定平衡;C.容器体积不变、容器内气体的物质的量是变量,所以压强是变量,容器中气体的压强保持不变一定平衡; D.单位时间内生成 n molCO 的同时生成 2n molH2,都是表示逆反应速率,反应不一定平衡。故选BC;
(Ⅱ)回答下列问题:(1)酸性越弱稀释相同倍数pH变化越小,根据提示,稀释相同倍数HX的PH变化大于CH3COOH,所以Ka(HX)> Ka(CH3COOH);
(2)25℃时,pH=6的溶液中![]() 、
、![]() ,根据电荷守恒CH3COOH与CH3COONa的混合溶液, C(CH3COO) + C(OH)= c(Na+)+ c(H+),C(CH3COO) - c(Na+)= c(H+)-C(OH)=
,根据电荷守恒CH3COOH与CH3COONa的混合溶液, C(CH3COO) + C(OH)= c(Na+)+ c(H+),C(CH3COO) - c(Na+)= c(H+)-C(OH)= ![]() =9.9×10-7。
=9.9×10-7。


科目:高中化学 来源: 题型:
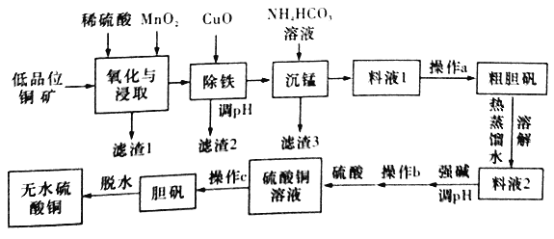
【题目】无水硫酸铜是一种重要的化学试剂,工业上用低品位钢矿(合CuS、Cu2S、CuO,以及FeO、Fe2O3、SiO2等杂质)制备无水硫酸铜的流程如下图所示:
(NH4)2SO4、CuSO4的溶解度(g)部分数据如下表所示:
温度 | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
S(CuSO4)/g | 17 | 20.7 | 24.4 | 28.5 | 33.6 | 40 | 77 |
S[(NH4)SO4]/g | 73 | 75.4 | 78.1 | 81.0 | 84.5 | 87.8 | 102 |
(1)氧化与浸取过程中发生的反应之一为Cu2S被MnO2氧化时有一种非全属单质生成,则该反应的离子方程式为____________,滤渣1的主要成分是__________(填化学式),除铁时加入CuO能得到滤渣2的原理是__________________。
(2)除铁后,为了判断滤液中是否有Fe3+残留,请设计实验方案:__________。
(3)沉锰时还有一种酸性气体生成,则沉锰时发生反应的离子方程式为___________。(已知pH=8.8时,Mn2+开始沉淀)。
(4)为了从料液1中尽可能多地析出粗胆矾,操作a的内容是__________(填名称)。
(5)工业上利用上述原理制备胆矾。已知:298K时,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=8.0×10-38。离子浓度小于1×10-5mol/L时表明该离子已完全沉淀。常温下,若某溶液中c(Cu2+)=2.2 mol/L,c(Fe3+)=O.001mol/L,加入氧化铜除铁时,调节溶液pH范围为________(lg5=0.7)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用硫酸渣(主要含Fe2O3、FeO,杂质为Al2O3和SiO2等)生产铁基颜料铁黄(FeOOH)的制备流程如下:

(1)“酸溶”时,Fe2O3与硫酸反应的化学方程式为____。
(2)滤渣I的主要成分是FeS2、S和______(填化学式);Fe3+被FeS2还原的离子方程式为______。
(3)“氧化”中,生成FeOOH的离子方程式为_______________。
(4)滤液II中溶质是Al2(SO4)3和______(填化学式):“洗涤”时,检验铁黄表而已洗涤干净的操作是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,13g某气体所含的分子数与14gCO 所含的分子数相等。此气体在标准状况下的密度为( )
A. 1.25g·L-1 B. 2.32 g·L-1 C. 1.65 g·L-1 D. 1.16 g·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列叙述中正确的是
A. 标准状况下,22.4 L 14CO2与44 g 14CO2含分子数均为NA
B. 1 mol CH3COOH与足量CH3CH2OH在浓硫酸存在下共热生成NA个乙酸乙酯分子
C. 常温下,pH=13的NaOH溶液中含OH-离子数为0.1 NA
D. 浓度为2 mol/L的FeCl3溶液500 mL水解后生成Fe(OH)3胶体粒子数目小于NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
①标准状况下,0.2 mol任何物质的体积均为4.48 L
②若1 mol气体的体积为22.4 L,则它一定处于标准状况下
③标准状况下,1 LCO和1 L H2O的物质的量相同
④标准状况下,1 g H2和14 g N2的体积相同
⑤28 g CO的体积为22.4 L
⑥两种物质的物质的量相同,则它们在标准状况下的体积也相同
⑦在同温同体积时,气体物质的物质的量越大,则压强越大
⑧同温同压下,气体的密度与气体的相对分子质量成正比
A. ①②③④ B. ②③⑥⑦⑧ C. ④⑦⑧ D. ⑤⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气在工业上有着重要的用途,某兴趣小组在实验室中模拟工业上用氯气制备无水氯化铝(无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾).可用下列装置制备.
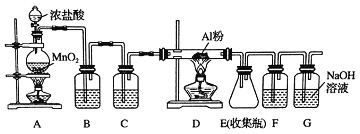
(1)装置B中盛放_____溶液,其作用是_____.F中的是_____溶液,其作用是_____.用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为_____.
(2)装置A实验开始时,先检查装置气密性,接下来的操作依次是_____(填序号).
A.往烧瓶中加入MnO2粉末 B.加热 C.往烧瓶中加入浓盐酸
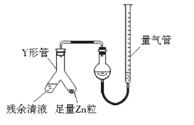
(3)制备反应会因盐酸浓度下降而停止.为测定反应残余液中盐酸的浓度,探究小组同学提出很多实验方案,其中方案之一为让残留的液体与足量Zn反应,测量生成的H2体积.装置如右图所示(夹持器具已略去).
①使Y形管中的残余清液与锌粒反应的正确操作是将_____转移到_____中.
②反应完毕,每间隔1分钟读取气体体积、气体体积逐渐减小,直至不变.气体体积逐次减小的原因是_____(排除仪器和实验操作的影响因素)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com