
【题目】已知醋酸、醋酸根离子在溶液中存在下列平衡及其对应的平衡常数:
CH3COOH![]() CH3COO-+H+ K1=1.75×10-5
CH3COO-+H+ K1=1.75×10-5
CH3COO-+H2O![]() CH3COOH+OH- K2=5.71×10-10
CH3COOH+OH- K2=5.71×10-10
常温下,将等体积、等物质的量浓度的醋酸和醋酸钠溶液混合,下列叙述正确的是( )
A.对混合溶液进行加热,K1增大、K2减小
B.混合溶液的pH>7
C.混合溶液中c(CH3COO-)>c(Na+)
D.温度不变,若在混合溶液中加入少量NaOH固体,c(CH3COO-)减小
科目:高中化学 来源: 题型:
【题目】4-溴环己烯(![]() )可与下列4种物质发生反应:①HBr、②酸性高锰酸钾溶液、③氢氧化钠的水溶液、④氢氧化钠的乙醇溶液。下列有关这些反应的说法中正确的是( )
)可与下列4种物质发生反应:①HBr、②酸性高锰酸钾溶液、③氢氧化钠的水溶液、④氢氧化钠的乙醇溶液。下列有关这些反应的说法中正确的是( )
A.与①反应后的有机产物只有一种
B.与②的反应原理类似于烯烃使溴水褪色
C.与③反应后得到的有机产物可被氧化为醛
D.与④反应后得到的有机产物只有一种官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各电离方程式中,书写正确的是( )
A.CH3COOH![]() H++CH3COO-
H++CH3COO-
B.KHSO4![]() K++H++ SO42-
K++H++ SO42-
C.Al(OH)3![]() Al3++3OH-
Al3++3OH-
D.H2CO3![]() 2H++ CO32-
2H++ CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近全国各地持续出现雾霾天气,其首要污染物是可吸入颗粒物PM2.5和氮、硫的氧化物(PM2.5直径接近2.5×10-6m,1纳米=10-9m),主要来源为工业废气、机动车尾气等。因此对PM2.5、SO2、NOx进行研究、处理意义重大。
(1) 下列关于PM2.5说法正确的是_______
a.PM2.5在空气中形成了胶体;
b.PM2.5表面积大,能吸附大量有毒、有害物质;
c.少开私家车,尽量选择公交、地铁出行,某种程度可以减少PM2.5污染
(2) 取PM2.5样本用蒸馏水处理制得试样,若测得该试样所含水溶性无机离子及其平均
浓度如下表
离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
浓度/ mol/L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中的数据判断该试样的酸碱性为_______,其pH=______。
(3)对汽车尾气中的NOx进行研究
①NOx能形成酸雨,写出NO2转化为HNO3的化学方程式___________。
②汽车尾气系统中装有催化转化器,可将NOx还原成N2排出,已知下列热化学方程式:
ⅰ N2(g) +O2(g)![]() 2NO(g) △H=+180.5kJ·mol-1
2NO(g) △H=+180.5kJ·mol-1
ⅱ 2C(s)+ O2(g)![]() 2CO(g) △H =- 221.0 kJ·mol-1
2CO(g) △H =- 221.0 kJ·mol-1
ⅲ C(s)+ O2(g)![]() CO2( g) △H =- 393.5 kJ·mol-1
CO2( g) △H =- 393.5 kJ·mol-1
温度升高,反应ⅲ化学平衡常数_________。(填“增大”或“减小”或“不变”)
写出NO(g)和CO(g) 反应生成N2(g) CO2(g)的热化学方程式_______________。
(4)将工厂废气中产生的SO2通过下列流程,可以转化为有应用价值的硫酸钙等
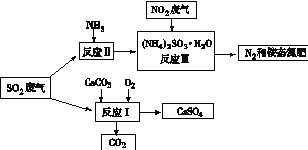
①写出反应Ⅰ的化学方程式:________________。
②生产中,向反应Ⅱ的溶液中加入强还原性的对苯二酚等物质,目的是___________。
③检验经过反应Ⅲ得到的氨态氮肥中SO42-所用试剂是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实,某化学兴趣小组在实验室中模拟上述过程,其设计的模拟装置如下:
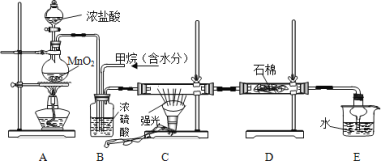
请回答:
(1)B 转置有两种功能:①干燥混合气体;②_____。
(2)D 转置的石棉中含有均匀混合了 KI 的淀粉糊,反应进行一段时间后其现象是_____。
(3)在 C 装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色固体小颗粒产生,你猜测生成黑色小颗粒的化学方程式可能是:_____。
(4)E 装置除吸收了 HCl 外,还含有有机物,从 E 中分离出盐酸的最佳方法为_____。该装还有缺陷, 原因是没有进行尾气处理,其尾气主要成分为_____(填序号)。
a.CH3Cl b.CH2Cl2 c.CHCl3 d.CCl4 e.CH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】基础知识与技能考查
(1)Na2S2O3与稀硫酸反应(化学方程式):___;
(2)泡沫灭火器是硫酸铝和碳酸氢钠溶液反应,写出相关离子方程式:___;
(3)为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种试剂,过滤后,再向滤液中加入适量的盐酸,这种试剂是___。(填写化学式,只填一种即可)
(4)碳酸氢钠溶液中:比较c(H2CO3)___c(CO32-)(答>,<,=)
(5)常温下,将0.1mol/L盐酸和0.1mol/L的NaOH按体积比11:9混合后,溶液的pH为___;
(6)写出碳酸钠溶液的物料守恒___;在2mol/L的氨水中,加入等体积1mol/L的盐酸,写出质子守恒(水的电离守恒):___;
(7)如图是甲烷燃料电池原理示意图,回答下列问题:电池的负极是___(填“a”或“b”)极,该极的电极反应式是___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X的分子式为C5H12Cl,用NaOH的醇溶液处理X,可得到分子式为C5H10的两种产物Y、Z。Y、Z经催化加氢后都可得到2-甲基丁烷.则X的结构简式可能为( )
A.![]() B.
B.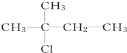
C.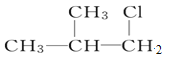 D.
D.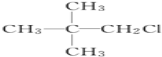
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。
(1)已知H2A在水中存在以下平衡:H2A=H++HA-,HA-![]() H++A2-。
H++A2-。
①等物质的量浓度的两种溶液:NaHA溶液的pH________(填“大于”“小于”或“等于”)Na2A溶液的pH。NaHA溶液中存在_______个平衡。
②某温度下,若向0.1mol·L-1的NaHA溶液中逐滴滴加0.1mol·L-1 KOH溶液至溶液呈中性。此时该混合溶液中,下列关系中一定正确的是________。
A.c(H+)·c(OH-)=1×10-14
B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)<c(K+)
D.c(Na+)+c(K+)=0.1mol·L-1
③已知常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:CaA(s)![]() Ca2+(aq)+A2-(aq) ΔH>0。若要使该溶液中Ca2+浓度变小,可采取的措施有________。
Ca2+(aq)+A2-(aq) ΔH>0。若要使该溶液中Ca2+浓度变小,可采取的措施有________。
A.升高温度 B.降低温度 C.加入NH4Cl晶体 D.加入Na2A固体
(2)已知:常温时CH3COOH![]() CH3COO-+H+,Ka=2×10-5则反应CH3COO-+H2O
CH3COO-+H+,Ka=2×10-5则反应CH3COO-+H2O![]() CH3COOH+OH-的平衡常数Kh=________。
CH3COOH+OH-的平衡常数Kh=________。
(3)常温下,若在0.10mol·L-1 CuSO4溶液中加入NaOH稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=________mol·L-1{Ksp[Cu(OH)2]=2.2×10-20}。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中存在大量的金属元素,其中钠、镁、铝、铁、铜等在工农业生产中有着广泛的应用。
(1)请写出Fe的基态原子核外电子排布式____________。
(2)金属A的原子只有3个电子层,其第一至第四电离能如下:
电离能/(kJ·mol-1) | I1 | I2 | I3 | I4 |
A | 932 | 1821 | 15 390 | 21 771 |
则A原子的价电子排布式为______________。
(3)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用醋酸二氨合铜(Ⅰ)溶液来吸收原料气体中的CO(Ac—代表CH3COO—),其反应是:[Cu(NH3)2]Ac+CO+NH3![]() [Cu(NH3)3CO]Ac[醋酸羰基三氨合铜(Ⅰ)] ΔH<0。
[Cu(NH3)3CO]Ac[醋酸羰基三氨合铜(Ⅰ)] ΔH<0。
①C、N、O三种元素的第一电离能由小到大的顺序为____________。
②配合物[Cu(NH3)3CO]Ac中心原子的配位数为____________。
③在一定条件下NH3与CO2能合成尿素[CO(NH2)2],尿素中C原子和N原子轨道的杂化类型分别为________;1 mol尿素分子中,σ键的数目为________。
(4)NaCl和MgO都属于离子化合物,NaCl的熔点为801.3 ℃,MgO的熔点高达2800 ℃。造成两种晶体熔点差距的主要原因是____________________________________。
(5)(NH4)2SO4、NH4NO3等颗粒物及扬尘等易引起雾霾。其中NH4+的空间构型是____________(用文字描述),与NO互为等电子体的分子是____________(填化学式)。
(6)铜的化合物种类很多,如图是氯化亚铜的晶胞结构(黑色球表示Cu+,白色球表示Cl-),已知晶胞的棱长为a cm,则氯化亚铜密度的计算式为ρ=________g·cm-3(用NA表示阿伏加德罗常数)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com