
【题目】为了测定某铜银合金的成分,将![]() 合金完全溶解于
合金完全溶解于![]() 的浓硝酸中,收集到
的浓硝酸中,收集到![]() 标准状况
标准状况![]() 的气体
的气体![]() 反应生成气体只有NO和
反应生成气体只有NO和![]() ,并测得溶液中
,并测得溶液中![]() ,假设反应前后溶液的体积不变,则气体中NO、
,假设反应前后溶液的体积不变,则气体中NO、![]() 的体积比为
的体积比为
A.1:1B.2:1C.3:1D.1:3
科目:高中化学 来源: 题型:
【题目】CO和苯都是重要的化工原料,如图是某有机物D的合成过程。已知化合物C可与水混溶。

请回答:
(1)反应①的反应类型是__。
(2)若反应③中原子利用率达100%,则反应③还应加的试剂是__(填化学式)。
(3)下列说法正确的是__(填序号)。
A.一定条件下,化合物C可与水反应生成
B.化合物A和C均为不饱和烃,均能使溴水褪色
C.水或碳酸钠溶液均能鉴别苯和化合物C,但不能用酸性KMnO4溶液鉴别
D.完全燃烧,等质量的A与苯耗氧量相等,等物质的量的A与B耗氧量也相等
(4)④的反应机理与制取乙酸乙酯相似,写出其化学方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分氧化的铁铜合金样品![]() 氧化产物为
氧化产物为![]() 、
、![]() 共
共![]() ,经如下处理,下列说法正确的是
,经如下处理,下列说法正确的是![]()
![]()
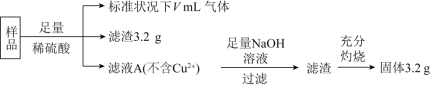
A.滤液A中的阳离子为![]() 、
、![]() 、
、![]()
B.样品中Fe元素的质量为![]()
C.样品中CuO的质量为![]()
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关晶体的结构如下图所示,下列说法中不正确的是
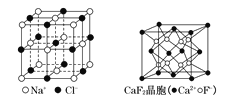
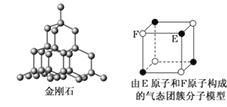
A.在NaCl晶体中,距Na+最近的Cl-形成正八面体
B.在CaF2晶体中,每个晶胞平均占有4个Ca2+
C.在金刚石晶体中,6个碳原子形成一个环且不在同一平面上
D.该气态团簇分子的分子式为EF或FE
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液![]() ,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解
,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解![]() 。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示
。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示![]() 已知硝酸只被还原为NO气体
已知硝酸只被还原为NO气体![]() 。下列分析或结果错误的是
。下列分析或结果错误的是

A.原混合酸中![]() 的物质的量为
的物质的量为![]()
B.OA段产生的是NO,AB段发生的反应为![]() ,BC段产生氢气
,BC段产生氢气
C.第二份溶液中最终溶质为![]()
D.![]() 浓度为
浓度为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为了探究一种浅绿色盐X(仅含四种元素,不含结晶水,M(X)<908gmol-1)的组成和性质,设计并完成了如下实验:
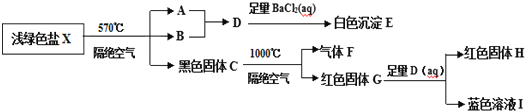
取一定量的浅绿色盐X进行上述实验,充分反应后得到23.3g白色沉淀E、28.8g红色固体G和12.8g红色固体H。
已知:①浅绿色盐X在570℃、隔绝空气条件下受热分解为非氧化还原反应;
②常温下B呈液态且1个B分子含有10个电子。
请回答如下问题:
(1)写出B分子的电子式___。
(2)已知G溶于稀硝酸,溶液变成蓝色,并放出无色气体。请写出该反应的离子方程式为___。
(3)在隔绝空气、570℃温度下加热X至完全分解的化学反应方程式为___。
(4)一定条件下,NH3与黑色固体C发生氧化还原反应得到红色固体和气体丙(丙是大气主要成分之一),写出一个可能的化学反应方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有的离子可能是K+、Ba2+、Al3+、Mg2+、![]() 、
、![]() 、
、![]() 、Cl-中的几种,现进行如下实验:
、Cl-中的几种,现进行如下实验:
①取少量原溶液,滴加氢氧化钠溶液的过程中无沉淀生成;
②另取少量原溶液,逐滴加入5 mL 0.2 mol·L-1盐酸,开始产生沉淀并逐渐增多,沉淀量基本不变后产生气体,最后沉淀逐渐减少至消失;
③在上述②沉淀消失后的溶液中,再加入足量的硝酸银溶液得到沉淀0.43 g。
下列说法中正确的是( )。
A.该溶液中一定不含Ba2+、Al3+、Mg2+、![]() 、Cl-
、Cl-
B.该溶液中一定含有K+、![]() 、
、![]() 、Cl-
、Cl-
C.该溶液中是否含有K+需做焰色反应(透过蓝色钴玻璃片观察)进行判断
D.该溶液中可能含有Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子反应中涉及![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 六种微粒.其中
六种微粒.其中![]() 的物质的量随时间变化的曲线如图所示.则下列判断正确的是( )
的物质的量随时间变化的曲线如图所示.则下列判断正确的是( )
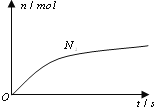
A.反应后溶液的酸性明显增强
B.消耗1mol还原剂,转移6mol电子
C.氧化剂与还原剂的物质的量之比为2:3
D.该反应的还原剂是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氯氨、二氯氨和三氯氨(NH2Cl、NHCl2和NCl3)是常用的饮用水二级消毒剂。
(1)用Cl2和NH3反应制备三氯胺的方程式为3Cl2(g)+NH3(g)NCl3(l)+3HCl(g),向容积均为1L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2molCl2和2molNH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
t /min | 0 | 40 | 80 | 120 | 160 |
甲(400℃)n(Cl2)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
乙(T℃)n(Cl2)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①T℃_____400℃(填“>”或“<”),该反应的ΔH____0(填“>”或“<”)。
②该反应自发进行的条件是__________(填高温、低温、任何温度)。
③对该反应,下列说法正确的是_________(填选项字母)。
A. 若容器内气体密度不变,则表明反应达到平衡状态
B. 若容器内Cl2和NH3物质的量之比为3∶1,则表明反应达到平衡状态
C. 反应达平衡后,其他条件不变,加入一定量的NCl3,平衡将向逆反应方向移动
D. 反应达到平衡后,其他条件不变,在原容器中按![]() 继续充入一定量反应物,达新平衡后Cl2的转化率增大
继续充入一定量反应物,达新平衡后Cl2的转化率增大
(2)工业上可利用反应2Cl2(g)+NH3(g)NHCl2(l)+2HCl(g)制备二氯胺。
①NHCl2在中性、酸性环境中会发生强烈水解,生成具有强杀菌作用的物质,写出该反应的化学方程式______________________________。
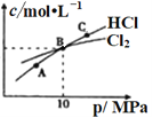
②在恒温条件下,将2molCl2和1molNH3充入某密闭容器中发生上述反应,测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示。则A、B、C三点中Cl2转化率最高的是________点(填“A”“B”或“C”);B点时反应物转化率:α(Cl2)____α(NH3)(填“>”“=”或“<”),若B点平衡体积为2L,则平衡常数K=_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com