
【题目】某研究小组为了探究一种浅绿色盐X(仅含四种元素,不含结晶水,M(X)<908gmol-1)的组成和性质,设计并完成了如下实验:
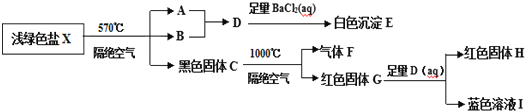
取一定量的浅绿色盐X进行上述实验,充分反应后得到23.3g白色沉淀E、28.8g红色固体G和12.8g红色固体H。
已知:①浅绿色盐X在570℃、隔绝空气条件下受热分解为非氧化还原反应;
②常温下B呈液态且1个B分子含有10个电子。
请回答如下问题:
(1)写出B分子的电子式___。
(2)已知G溶于稀硝酸,溶液变成蓝色,并放出无色气体。请写出该反应的离子方程式为___。
(3)在隔绝空气、570℃温度下加热X至完全分解的化学反应方程式为___。
(4)一定条件下,NH3与黑色固体C发生氧化还原反应得到红色固体和气体丙(丙是大气主要成分之一),写出一个可能的化学反应方程式___。
【答案】![]() 3Cu2O+14H++2NO3-=6Cu2++2NO↑+7H2O Cu4(OH)6SO4
3Cu2O+14H++2NO3-=6Cu2++2NO↑+7H2O Cu4(OH)6SO4![]() 4CuO+SO3↑+3H2O↑ 3CuO+2NH3
4CuO+SO3↑+3H2O↑ 3CuO+2NH3![]() N2+3Cu2O+3H2O
N2+3Cu2O+3H2O
【解析】
浅绿色盐X在570℃、隔绝空气条件下受热分解为非氧化还原反应,得到A、B和黑色固体C,常温下B呈液态,且1个B分子含有10个电子,B为水;A和水反应生成的D能和氯化钡反应生成白色沉淀E,E只能为硫酸钡,则A为SO3,D为H2SO4;黑色固体C可能为四氧化三铁、氧化铜、碳等,黑色固体C隔绝空气在1000℃反应生成气体F和红色固体G,G能和硫酸反应生成红色固体和蓝色溶液应为氧化亚铜在酸性溶液中的歧化反应,Cu2O+H2SO4=CuSO4+Cu+H2O,所以红色固体G为氧化亚铜,气体F为氧气,红色固体H为铜,蓝色溶液I为硫酸铜,黑色固体C为氧化铜,据此分析解答。
(1)B为水,水是共价化合物,氢原子和氧原子之间以共价键结合,其电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)红色固体G为氧化亚铜,Cu2O中+1价的铜被硝酸氧化,稀硝酸被还原成一氧化氮,反应的离子方程式为:3Cu2O+14H++2NO3-═6Cu2++2NO↑+7H2O,故答案为:3Cu2O+14H++2NO3-═6Cu2++2NO↑+7H2O;
(3)根据上述分析,A为SO3, B为水,C为氧化铜,D为H2SO4,E为硫酸钡,F为氧气,G为氧化亚铜,H为铜,I为硫酸铜。23.3g白色沉淀E(硫酸钡)的物质的量为n=![]() =0.1mol,浅绿色盐X中n(Cu)=0.4mol,n(S)=0.1mol,n(CuO)∶n(SO3)=1∶4,仅含四种元素,不含结晶水,设化学式为:Cu4(OH)mSO4,Cu4(OH)mSO4
=0.1mol,浅绿色盐X中n(Cu)=0.4mol,n(S)=0.1mol,n(CuO)∶n(SO3)=1∶4,仅含四种元素,不含结晶水,设化学式为:Cu4(OH)mSO4,Cu4(OH)mSO4 ![]() 4CuO+SO3↑+
4CuO+SO3↑+![]() H2O↑,根据氧元素守恒得:m=6,符合M(X)<908gmol-1,则该反应流程为:X在隔绝空气、570℃温度下加热Cu4(OH)6SO4
H2O↑,根据氧元素守恒得:m=6,符合M(X)<908gmol-1,则该反应流程为:X在隔绝空气、570℃温度下加热Cu4(OH)6SO4 ![]() 4CuO+SO3↑+3H2O↑,故答案为:Cu4(OH)6SO4
4CuO+SO3↑+3H2O↑,故答案为:Cu4(OH)6SO4 ![]() 4CuO+SO3↑+3H2O↑;
4CuO+SO3↑+3H2O↑;
(4)空气的主要成分为氧气、氮气,黑色固体C为氧化铜,与氨气反应生成氮气,气体丙为氮气、铜(0价)或氧化亚铜(铜为+1价)和水,红色固体为铜或氧化亚铜,反应的化学方程式可能为:3CuO+2NH3 ![]() N2+3Cu+3H2O或3CuO+2NH3
N2+3Cu+3H2O或3CuO+2NH3![]() N2+3Cu2O+3H2O,故答案为:3CuO+2NH3
N2+3Cu2O+3H2O,故答案为:3CuO+2NH3 ![]() N2+3Cu+3H2O或3CuO+2NH3
N2+3Cu+3H2O或3CuO+2NH3![]() N2+3Cu2O+3H2O。
N2+3Cu2O+3H2O。


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:
【题目】高分子化合物G是一种聚酯材料,其一种合成路线如下:

回答下列问题:
(1)A的名称是______,C含有的官能团名称是______。
(2)反应![]() 的反应类型是______。
的反应类型是______。
(3)反应![]() 的化学方程式为______。
的化学方程式为______。
(4)反应③~⑤中引入![]() 的作用是______。
的作用是______。
(5)满足下列条件的C的同分异构体共有______种![]() 不含立体异构
不含立体异构![]() 。
。
![]() 能使
能使![]() 溶液显紫色;能与NaHCO3发生反应。
溶液显紫色;能与NaHCO3发生反应。![]() 苯环上有两个取代基。
苯环上有两个取代基。
其中核磁共振氢谱显示为6组峰,峰面积之比为1:2:2:2:2:1,该有机物的结构简式是______。
(6)参照上述合成路线,以![]() 为原料,设计制备
为原料,设计制备 的合成路线______。
的合成路线______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】材料是人类赖以生存和发展的重要物质基础,回答下列问题:
(1)下列生产工艺能获取新型无机非金属材料的是 ______ (填序号)。
①采用甲烷为原料,在微波和其他条件下生产金刚石
②采用传统方法用焦炭还原SiO2制备单晶硅
③在水泥生产过程中加入高炉矿渣生产特殊用途的水泥
④在玻璃生产过程中加入K、Pb生产其有特殊用途的光学玻璃
(2)某炼铁高炉中一次投入磁铁矿冶炼生铁,若该过程中转移的电子为1.60×105mol,不考虑其他的反应,也不考虑生铁中的杂质,则炼得的生铁为 ______t。生铁中含碳、硫等元素较多,炼钢是以生铁为原料,除去过多的碳、硫等杂质元素,其中除去硫的化学方程式为 ______。
(3)工业炼金属Al的工艺流程如下:
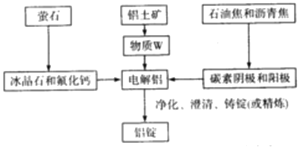
该工艺中冰晶石和氟化钙的作用是 ______,物质W的化学式为 ______ ;若铝土矿的纯度为60%,提取W的损失率为3%,电解时损失率为0.1%,粗铝净化时的损失率为2%,铝锭中铝的含量为99.9%,那么1.0t铝土矿可制备铝锭 ______t。
(4)金属腐蚀带来的损失无法估量。钢铁腐蚀多为吸氧腐蚀,其正极反应式为 ______,金属防腐措施很多,其中牺牲阳极(金属Zn)的阴极保护法的“阴极”反应式为 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有图1、2所示的装置,下列叙述正确的是( )


图1 图2
A.将乙烯分别通入两个装置中,二者都褪色且原理相同
B.若某气体均能使二者褪色,说明该气体一定含乙烯
C.二者都可用于除去乙烷中混有的乙烯
D.二者都可用于鉴别乙烷和乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定某铜银合金的成分,将![]() 合金完全溶解于
合金完全溶解于![]() 的浓硝酸中,收集到
的浓硝酸中,收集到![]() 标准状况
标准状况![]() 的气体
的气体![]() 反应生成气体只有NO和
反应生成气体只有NO和![]() ,并测得溶液中
,并测得溶液中![]() ,假设反应前后溶液的体积不变,则气体中NO、
,假设反应前后溶液的体积不变,则气体中NO、![]() 的体积比为
的体积比为
A.1:1B.2:1C.3:1D.1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列叙述正确的是
A.1.0L 1.0mol·L-1的NaAlO2水溶液中含有的氧原子数为2NA
B.12g石墨烯(单层石墨)中含有六元环的个数0.5NA
C.25℃时pH=13的NaOH溶液中含有OH-的数目为0.1NA
D.1mol的羟基与1mol的氢氧根离子所含电子数均为9NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构为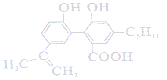 ,下列说法正确的是( )
,下列说法正确的是( )
A. 1 mol该有机物最多可以与7 mol H2发生加成反应
B. 该有机物可以发生取代、加成、氧化、水解等反应
C. 0.1 mol该有机物与足量金属钠反应最多可以生成3.36L H2
D. 与该有机物具有相同官能团的同分异构体共有8种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.烷烃的通式为CnH2n+2,随n值增大,碳元素的质量百分含量逐渐减小
B.乙烯与溴水发生加成反应的产物为溴乙烷
C.1mol苯恰好与3mol氢气完全加成,说明一个苯分子中有三个碳碳双键
D.C7H16,主链上有5个碳原子的同分异构体共有5种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com