
【题目】高分子化合物G是一种聚酯材料,其一种合成路线如下:

回答下列问题:
(1)A的名称是______,C含有的官能团名称是______。
(2)反应![]() 的反应类型是______。
的反应类型是______。
(3)反应![]() 的化学方程式为______。
的化学方程式为______。
(4)反应③~⑤中引入![]() 的作用是______。
的作用是______。
(5)满足下列条件的C的同分异构体共有______种![]() 不含立体异构
不含立体异构![]() 。
。
![]() 能使
能使![]() 溶液显紫色;能与NaHCO3发生反应。
溶液显紫色;能与NaHCO3发生反应。![]() 苯环上有两个取代基。
苯环上有两个取代基。
其中核磁共振氢谱显示为6组峰,峰面积之比为1:2:2:2:2:1,该有机物的结构简式是______。
(6)参照上述合成路线,以![]() 为原料,设计制备
为原料,设计制备 的合成路线______。
的合成路线______。
【答案】苯乙醛 羟基、羧基 取代反应 n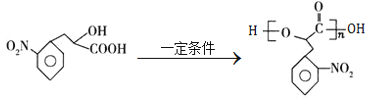 +(n-1)H2O 占据取代基的对位,将
+(n-1)H2O 占据取代基的对位,将![]() 引入取代基的邻位 6
引入取代基的邻位 6 
【解析】
A和HCN发生加成反应生成B,根据B结构简式及A分子式知,A为![]() ,B在酸性条件下发生水解反应生成C,C发生取代反应生成D;D发生取代反应生成E,E发生水解反应生成F,F发生缩聚反应生成G,据此解答。
,B在酸性条件下发生水解反应生成C,C发生取代反应生成D;D发生取代反应生成E,E发生水解反应生成F,F发生缩聚反应生成G,据此解答。
(1)A为![]() ,A的名称是苯乙醛,C为
,A的名称是苯乙醛,C为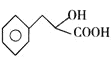 含有的官能团名称是羟基、羧基。
含有的官能团名称是羟基、羧基。
(2)反应④的反应类型是取代反应。
(3)反应⑥的化学方程式为n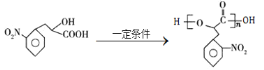 +(n-1)H2O。
+(n-1)H2O。
(4)反应③⑤中引入![]() 的作用是占据取代基的对位,将硝基引入取代基的邻位。
的作用是占据取代基的对位,将硝基引入取代基的邻位。
(5)满足下列条件的C的同分异构体:![]() 能使
能使![]() 溶液显紫色,说明含有酚羟基;能与NaHCO3发生反应,说明含有羧基。
溶液显紫色,说明含有酚羟基;能与NaHCO3发生反应,说明含有羧基。![]() 苯环上有两个取代基,其中一个为酚羟基;如果取代基为-CH2CH2COOH,有邻间对3种;如果取代基为-CH(CH3)COOH,有邻间对3种;共6种,其中核磁共振氢谱显示为6组峰,峰面积之比为1:2:2:2:2:1,结构对称,该有机物的结构简式是
苯环上有两个取代基,其中一个为酚羟基;如果取代基为-CH2CH2COOH,有邻间对3种;如果取代基为-CH(CH3)COOH,有邻间对3种;共6种,其中核磁共振氢谱显示为6组峰,峰面积之比为1:2:2:2:2:1,结构对称,该有机物的结构简式是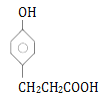 。
。
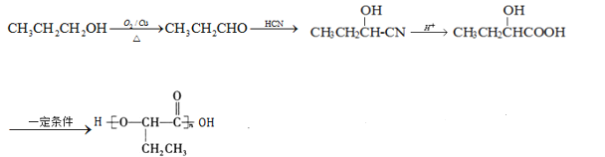
(6)参照上述合成路线,以![]() 为原料,制备
为原料,制备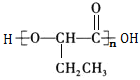 ,1-丙醇发生催化氧化生成丙醛,丙醛和HCN发生加成反应,然后发生水解反应,最后发生缩聚反应生成目标产物,其合成路线为:
,1-丙醇发生催化氧化生成丙醛,丙醛和HCN发生加成反应,然后发生水解反应,最后发生缩聚反应生成目标产物,其合成路线为: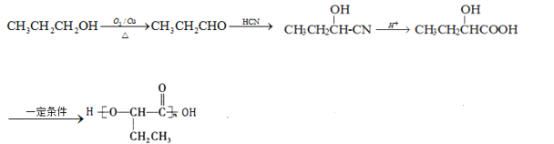 。
。


科目:高中化学 来源: 题型:
【题目】用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,试根据实验回答:
(1)将准确称取的4.3g烧碱样品配成250mL待测液,需要的主要仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有___、___。
(2)取10.00mL待测液,用___滴定管量取。
(3)用0.2010mol/L标准盐酸滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视___,直到滴定到终点。
(4)根据下列数据,c(NaOH)=___,烧碱的纯度为___。
滴定次数 | 待测液体积 (mL) | 标准盐酸的体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 10.00 | 0.50 | 20.40 |
第二次 | 10.00 | 4.00 | 24.10 |
(5)以标准盐酸溶液滴定未知的氢氧化钠溶液为例,判断下列操作引起的误差(填偏大、偏小、无影响)
①读数:滴定前平视,滴定后俯视___。
②未用标准液润洗滴定管___。
③用待测液润洗锥形瓶___。
④不小心将标准液滴在锥形瓶外面___。
⑤滴定接近终点时,用少量蒸馏水冲洗锥形瓶内壁___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学学习小组设计以下实验方案,测定某含有NaCl的小苏打样品中![]() 的质量分数。
的质量分数。
(方案一)查资料:NaCl加热至![]() 时熔化而不分解,
时熔化而不分解,![]() 受热分解,
受热分解,![]() 。由此设计实验:用电子天平称取
。由此设计实验:用电子天平称取![]() 样品,置于坩埚中用酒精灯加热(如图,灼烧温度高于
样品,置于坩埚中用酒精灯加热(如图,灼烧温度高于![]() ,不超过
,不超过![]() ),至恒重后,冷却,称量剩余固体质量为
),至恒重后,冷却,称量剩余固体质量为![]() 。
。
(1)实验中至少称量____次。
(2)实验中,达到恒重操作的标准是__________。
(方案二)根据“![]() 溶液呈碱性,
溶液呈碱性,![]() ”的性质设计实验:准确称取1.000 g样品,用容量瓶配成100 mL溶液,用滴定管量取20.00 mL于锥形瓶中,加入2滴甲基橙为指示剂,用0.1000mol/L盐酸标准溶液滴定。平行两份,两次实验的数据如下:
”的性质设计实验:准确称取1.000 g样品,用容量瓶配成100 mL溶液,用滴定管量取20.00 mL于锥形瓶中,加入2滴甲基橙为指示剂,用0.1000mol/L盐酸标准溶液滴定。平行两份,两次实验的数据如下:
1 | 2 | |
| 20.00 | 20.00 |
| 0.00 | 0.20 |
| 19.98 | 20.22 |
(3)实验中,当其它操作均正确时,下列操作不会引起实验误差的是(______)。
A.容量瓶用蒸馏水洗净后,瓶内有水残留,直接配制溶液
B.滴定管内壁有水珠就装入标准液
C.锥形瓶内壁有水珠,用待测液润洗后再使用
D.锥形瓶用蒸馏水洗净后,直接放入待测液进行测定
span>(4)滴定终点的判断:__________。
(5)两次实验消耗盐酸体积的平均值为__________mL。
(6)样品中![]() 的质量分数__________。
的质量分数__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 分解速率受多种因素影响。实验测得
分解速率受多种因素影响。实验测得![]() 时不同条件下
时不同条件下![]() 浓度随时间的变化如图所示
浓度随时间的变化如图所示![]() 起始浓度均为
起始浓度均为![]() 。下列说法正确的是
。下列说法正确的是![]()
![]()
实验条件 |
|
|
|
① | 0 | 0 | |
② |
| 0 | |
③ |
| 3 | |
④ |
| 3 |
A.![]() 内,④条件下
内,④条件下![]() 的平均反应速率为
的平均反应速率为![]()
B.分析②③条件可知,![]() 浓度越大,
浓度越大,![]() 分解速率越慢
分解速率越慢
C.少量![]() 存在时,溶液碱性越强,
存在时,溶液碱性越强,![]() 分解速率越快
分解速率越快
D.分析①②条件可知,无![]() 时,碱性条件有利于双氧水的分解
时,碱性条件有利于双氧水的分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和苯都是重要的化工原料,如图是某有机物D的合成过程。已知化合物C可与水混溶。

请回答:
(1)反应①的反应类型是__。
(2)若反应③中原子利用率达100%,则反应③还应加的试剂是__(填化学式)。
(3)下列说法正确的是__(填序号)。
A.一定条件下,化合物C可与水反应生成
B.化合物A和C均为不饱和烃,均能使溴水褪色
C.水或碳酸钠溶液均能鉴别苯和化合物C,但不能用酸性KMnO4溶液鉴别
D.完全燃烧,等质量的A与苯耗氧量相等,等物质的量的A与B耗氧量也相等
(4)④的反应机理与制取乙酸乙酯相似,写出其化学方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有图1、2所示的装置,下列叙述正确的是( )


图1 图2
A.将乙烯分别通入两个装置中,二者都褪色且原理相同
B.若某气体均能使二者褪色,说明该气体一定含乙烯
C.二者都可用于除去乙烷中混有的乙烯
D.二者都可用于鉴别乙烷和乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某恒容密闭容器中,按物质的量之比为 1:1 投入 A 和 B,发生以下反应:A(g)+ B(?)![]() aD(g)(a 为正整数)。达平衡后,如果升高温度时,D 的质量分数增加;减小压强,D 的质量分数减小。在一定温度和一定压强下达平衡时,D 的物质的量分数为 50%,则下列说法正确的是
aD(g)(a 为正整数)。达平衡后,如果升高温度时,D 的质量分数增加;减小压强,D 的质量分数减小。在一定温度和一定压强下达平衡时,D 的物质的量分数为 50%,则下列说法正确的是
A.B 可能是固体也可能是液体
B.该反应的△H<0
C.在一定温度和一定压强下达平衡时,A 的转化率为 67%
D.当混合气体密度不变时,该反应达平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将0.1mol下列物质分别投入90g水中充分混合:①Na②NaOH③Na2O④Na2O2,所得溶液中OH-物质的量浓度大小排列顺序正确的是( )
A.③>④>②>①B.④>③>②>①
C.①>④=③>②D.③=④>①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为了探究一种浅绿色盐X(仅含四种元素,不含结晶水,M(X)<908gmol-1)的组成和性质,设计并完成了如下实验:
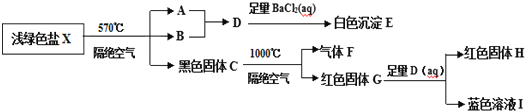
取一定量的浅绿色盐X进行上述实验,充分反应后得到23.3g白色沉淀E、28.8g红色固体G和12.8g红色固体H。
已知:①浅绿色盐X在570℃、隔绝空气条件下受热分解为非氧化还原反应;
②常温下B呈液态且1个B分子含有10个电子。
请回答如下问题:
(1)写出B分子的电子式___。
(2)已知G溶于稀硝酸,溶液变成蓝色,并放出无色气体。请写出该反应的离子方程式为___。
(3)在隔绝空气、570℃温度下加热X至完全分解的化学反应方程式为___。
(4)一定条件下,NH3与黑色固体C发生氧化还原反应得到红色固体和气体丙(丙是大气主要成分之一),写出一个可能的化学反应方程式___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com