
| A、0.5mo/L |
| B、0.25mol/L |
| C、0.1mol/L |
| D、1mol/L |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
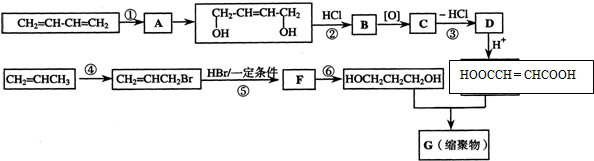
查看答案和解析>>
科目:高中化学 来源: 题型:
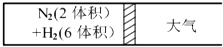 在一定的温度下,把2体积N2和6体积H2分别通入一个带活塞的体积可变的容器中,活塞的一端与大气相通容器中发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0 反应达到平衡后,测得混合气体为7体积.
在一定的温度下,把2体积N2和6体积H2分别通入一个带活塞的体积可变的容器中,活塞的一端与大气相通容器中发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0 反应达到平衡后,测得混合气体为7体积.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.12mol |
| B、0.11mol |
| C、0.99mol |
| D、0.08mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、6.0g金刚石中含有的共价键数为NA |
| B、56g铁粉与酸反应失去的电子数一定为0.2 NA |
| C、1 mol?L-1AlCl3溶液中含有3NA个Cl |
| D、标况下,11.2LSO3所含的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在FeI2溶液中滴入几滴稀溴水:Fe2++Br2=2Fe3++2Br- |
| B、FeCl3溶液中滴加过量Na2S溶液:2Fe3++S2-═2Fe2++S↓ |
| C、在NaHSO3溶液中滴入Ca(OH)2溶液:HSO3-+OH-=SO32-+H2O |
| D、等物质的量浓度、等体积的NaHSO4溶液与Ba(OH)2溶液混合:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
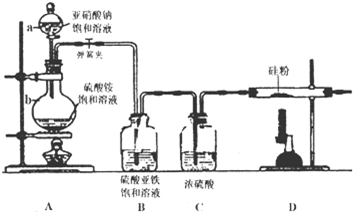
查看答案和解析>>
科目:高中化学 来源: 题型:
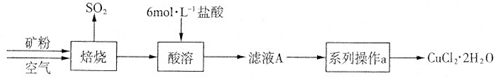

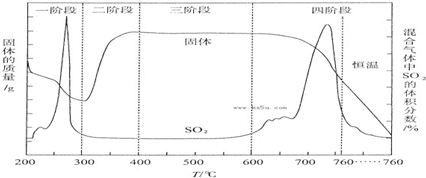
| ① |
| ② |
| ③ |
| ④ |
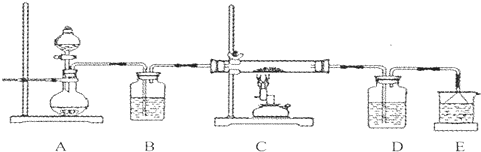
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com