
【题目】向2 L密闭容器中加入一定量的固体A和气体B,发生反应A(s)+2B(g) ![]() D(g)+E(g)ΔH=Q kJ·mol-1。在T1 ℃时,反应进行到不同时间测得各物质的物质的量如表:
D(g)+E(g)ΔH=Q kJ·mol-1。在T1 ℃时,反应进行到不同时间测得各物质的物质的量如表:
时间(min) 物质的量(mol) | 0 | 10 | 20 | 30 | 40 | 50 |
B | 2.00 | 1.36 | 1.00 | 1.00 | 1.20 | 1.20 |
D | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
E | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
(1)T ℃时,该反应的平衡常数K=____________________________。
(2)30 min后,只改变某一条件,反应重新达到平衡,据表中数据判断改变的条件可能是_____(填编号)。
a.通入一定量的B b.加入一定量的固体A c.适当缩小容器的体积
d.升高反应体系温度 e.同时加入0.2 mol B、0.1 mol D、0.1 mol E
(3)对于该反应,用各物质表示的反应速率与时间的关系示意曲线为下图中的____________(填序号)。
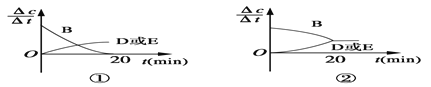

(4)容器的体积和温度T1 ℃不变,向该容器中加入1.60 mol B、0.20 mol D、0.20 mol E和n mol A,达到平衡后,与表格中20分钟时各物质的浓度完全相同,投入固体A的物质的量n的取值范围是______。
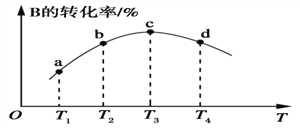
(5)若该密闭容器绝热,实验测得B的转化率随温度变化的示意图如图所示。由图可知,Q________0(填“大于”或“小于”),c点v正________v逆(填“大于”、“小于”或“等于”)。
【答案】 0.25 ae ④ >0.3 小于 等于
【解析】(1)向2 L密闭容器发生可逆反应,20分钟内达到平衡状态,
A(s)+2B(g) ![]() D(g)+E(g) ΔH=Q kJ·mol-1
D(g)+E(g) ΔH=Q kJ·mol-1
起始量 1mol/L 0 0
变化量 0.5 0.25 0.25
平衡量: 0.5 0.25 0.25
T ℃时,该反应的平衡常数K=c(E)×c(D)/c2(B)= 0.25×0.25/0.52= 0.25;正确答案:0.25。
(2)30 min后,n(B)增加,n(D)、n(E)均增加,说明平衡右移,通入一定量的B可以实现, a 正确;改变固体A的量对平衡移动无影响,其它物质的物质的量不发生变化,b错误;适当缩小容器的体积,增大压强,平衡不移动,各物质的量不变,c错误;升高反应体系温度,平衡移动,但是反应物和生成物不能同时增加, d错误;同时加入0.2 mol B、0.1 mol D、0.1 mol E,平衡不移动,各物质的量均增加,e正确;正确选项:ae。
(3)横坐标为时间,纵坐标为浓度的变化量和时间的比值,对于B来说,是物质的量的减小,对于D(g)或 E (g)来说,是物质的量的增加,且比值大约为2:1,只有④ 符合题意,正确选项④。
(4)按题中所建立的平衡,B物质的变化量为0.6 mol,根据方程式,A的变化量为0.3 mol,为顺利达到此平衡,A的量大于0.3 mol,正确答案:>0.3。
(5)B的转化率随着时间变化先增大后减小,说明该反应为放热反应,Q<0,c点为平衡点,v正=v逆,正确答案:小于;等于。


科目:高中化学 来源: 题型:
【题目】25 ℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO | NH3·H2O | H2SO3 |
电离平衡常数 | 1.8×10-5 | K1=4.2×10-7 K2=5.6×10-11 | 4.7×10-8 | 1.8×10-5 | Ka1=1.3×102 Ka2=6.2×108 |
(1)25℃时,等浓度的Na2CO3溶液、CH3COONa溶液、Na2SO3溶液,3种溶液的pH由大到小的顺序为____________________________________________。
(2)工业上可用氨水除去尾气SO2。
①若氨水的浓度为2.0 mol·L-1,溶液中的c(OH)=________mol·L1。向该氨水中加入少量NH4Cl固体,溶液的pH__________(填“升高”或“降低”);若加入少量明矾,溶液中NH![]() 的浓度____________(填“增大”或“减小”)。
的浓度____________(填“增大”或“减小”)。
②将SO2通入氨水中,当c(OH)降至1.0×107 mol·L1时,溶液中的c(![]() )/c(
)/c(![]() )=_________________。
)=_________________。
(3)若某溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)
___________c(NH3·H2O)(填“大于”、“小于”或“等于”,下同);混合前酸中c(H+)和碱中c(OH-)的关系为c(H+)____________c(OH-)。
(4)根据表中所给的信息,向NaClO溶液中通入少量CO2气体,发生反应的离子方程式为____________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.0500 mol·L-1H2C2O4(二元弱酸)溶液滴定 25.00 mL 0.100 0 mol L-1NaOH溶液所得滴定曲线如右图。下列说法正确的是( )

A. 点①所示溶液中:c(H+)+c(H2C2O4)+ c(HC2O4-)=c(OH-)
B. 点②所示溶液中:c(HC2O4-)+c(C2O42-)=c(Na+)
C. 点③所示溶液中:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
D. 滴定过程中可能出现:c(Na+) > c(C2O42-) =c(HC2O4-)>C(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.硫酸工业中废渣称为硫酸渣,其成分为SiO2、Fe2O3、Al2O3、MgO。某学习小组的同学设计以下方案,进行硫酸渣中金属元素的提取实验。

已知:溶液pH=3.7时,Fe3+已经沉淀完全;一水合氨饱和溶液中c(OH-)约为1×10-3 mol·L-1。
(1)写出A与氢氧化钠溶液反应的化学方程式:______________。
(2)上述流程中两次使用试剂①,推测试剂①应该是________ (填字母)。
A.氢氧化钠 B.氧化铝 C.氨水 D.水
(3)H中溶质是________。
(4)溶液D到固体E过程中需要控制溶液pH=13,如果pH过小,可能导致的后果是_______的化学式
(5)计算溶液F中的c(Mg2+)=___________________(25 ℃时,氢氧化镁的Ksp=5.6×10-12)。
II.某化学兴趣小组用下图所示装置进行电化学原理的实验探究.
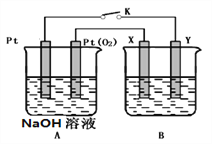
(1)A装置为乙醇燃料电池,若X、Y均是铜,电解质溶液为NaOH溶液,电池工作一段时间,X极附近生成砖红色沉淀,查阅资料得知是Cu2O,试写出该电极发生的电极反应式为___________。
(2)若B电池的电解质溶液为500 mL 1.0mol/L的NaCl溶液,X、Y皆为惰性电极,当电池工作一段时间断开电源K,Y电极有560mL(标准状况)无色气体生成(假设电极产生气体完全溢出,溶液体积不变),此时B电池溶液的pH=_______,要使该溶液恢复到原来的状态,需加入___________(填物质并注明物质的量)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g)![]() 2C(g)+2D(g),在不同情况下测得反应速率,其反应速率最快的是
2C(g)+2D(g),在不同情况下测得反应速率,其反应速率最快的是
A. υ(D)=0.4 mol / (L·s)
B. υ(C)=0.5 mol / (L·s)
C. υ(B)=0.6 mol / (L·s)
D. υ(A)=0.15 mol / (L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用含铜、铁的粗锌制备硫酸锌及相关物质。工艺流程图及有关数据如下:

物质 | Cu(OH)2 | Zn(OH)2 | Fe(OH)3 | ZnS | CuS |
Ksp | 5.0×10-20 | 2.0×10-16 | 4.0×10-38 | 1.2×10-23 | 8.5×10-45 |
请回答下列问题:
(1)粗锌中的铜与混酸的稀溶液反应的化学方程式为__________________________,图中处理气体X要能够体现绿色化学思想,还需补充气体______(填化学式)。
(2)若溶液I中c(Cu2+)为0.05mol·L-1,则溶液II中c(Fe3+)>____mol·L-1。
(3)若固体A是Zn,取9.61 g固体C溶解于足量的500mL 2 mol·L-1稀硝酸中,共收集到标准状况下2.24L的气体,向所得溶液中加入2 mol·L-1NaOH溶液,则当生成沉淀最多时,沉淀的质量为_____g;若固体A是另一种物质,取部分固体C于试管中,加入盐酸产生有臭鸡蛋味气体,则该反应的离子方程式为________________________。
(4)溶液Ⅲ经过蒸发浓缩、____________、过滤、洗涤、干燥,即得到较纯净的硫酸锌晶体;溶液还可以制备ZnS,实际选择的是(NH4)2S溶液而不是Na2S溶液作为反应物,理由是后者制得的ZnS含有较多的杂质,则该杂质是____________(填化学式)。
(5)金属锌常用作酸性干电池的负极,干电池不使用时,由于负极与电解质溶液接触而发生自放电反应:2NH4++Zn=2NH3+H2↑+Zn2+,造成电量自动减少。写出铅蓄电池不使用时,其正极上发生自放电的化学方程式__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
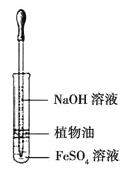
【题目】下列相关实验的叙述中,正确的是( )
A. HClO、活性炭均能使某些有色物质褪色,说明二者均有氧化性
B. 加热分别盛有NaHCO3和碘的两支试管,试管底部固体均减少,说明二者均发生升华
C. 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的液态铝滴落下来
D. 用上图装置观察 Fe(OH)2 的生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:
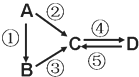
(1)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。写出②反应的离子方程式_________;④反应离子方程式__________。
(2)若A是应用最广泛的金属。④反应用到A,②⑤反应均用到同一种黄绿色气体单质。写出A与水高温下反应的化学方程式_______________________。④反应的离子方程式______________。D中加入氢氧化钠的现象__________。
(3)若A是太阳能电池用的光伏材料,B常用用于制作高档光学器材,C、D为钠盐,C的水溶液俗称泡花碱,D的溶液显碱性。④反应也是通入一种引起温室效应的主要气体。写出③反应的化学方程式________________________。⑤反应用到B,反应条件为高温,则⑤的化学方程式为____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com