
【题目】I.硫酸工业中废渣称为硫酸渣,其成分为SiO2、Fe2O3、Al2O3、MgO。某学习小组的同学设计以下方案,进行硫酸渣中金属元素的提取实验。

已知:溶液pH=3.7时,Fe3+已经沉淀完全;一水合氨饱和溶液中c(OH-)约为1×10-3 mol·L-1。
(1)写出A与氢氧化钠溶液反应的化学方程式:______________。
(2)上述流程中两次使用试剂①,推测试剂①应该是________ (填字母)。
A.氢氧化钠 B.氧化铝 C.氨水 D.水
(3)H中溶质是________。
(4)溶液D到固体E过程中需要控制溶液pH=13,如果pH过小,可能导致的后果是_______的化学式
(5)计算溶液F中的c(Mg2+)=___________________(25 ℃时,氢氧化镁的Ksp=5.6×10-12)。
II.某化学兴趣小组用下图所示装置进行电化学原理的实验探究.
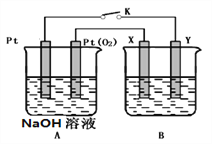
(1)A装置为乙醇燃料电池,若X、Y均是铜,电解质溶液为NaOH溶液,电池工作一段时间,X极附近生成砖红色沉淀,查阅资料得知是Cu2O,试写出该电极发生的电极反应式为___________。
(2)若B电池的电解质溶液为500 mL 1.0mol/L的NaCl溶液,X、Y皆为惰性电极,当电池工作一段时间断开电源K,Y电极有560mL(标准状况)无色气体生成(假设电极产生气体完全溢出,溶液体积不变),此时B电池溶液的pH=_______,要使该溶液恢复到原来的状态,需加入___________(填物质并注明物质的量)。
【答案】 SiO2+2NaOH = Na2SiO3 + H2O A NaHCO3 AI3+不能完全变为偏铝酸根 5.6×10-10 2Cu-2e-+2OH-=Cu2O + H2O 13 0.05mol HCI
【解析】I.(1)硫酸渣中只有SiO2不与盐酸反应,但能够和强碱反应生成硅酸钠和水,反应的化学方程式:SiO2+2NaOH = Na2SiO3 + H2O ;正确答案:SiO2+2NaOH = Na2SiO3 + H2O。
(2)加入试剂①的目的要调节溶液的pH,加入的试剂既能与酸反应,同时溶液的pH能够调整到pH=13,只能用氢氧化钠溶液才能达到,一水合氨饱和溶液中c(OH-)约为1×10-3 pH=11,达不到pH=13;氧化铝不能调整溶液到碱性, 正确选项A。
(3)F溶液中含有偏铝酸根离子,通入足量的二氧化碳气体,生成氢氧化铝和碳酸氢钠,所以H中溶质是NaHCO3,正确答案:NaHCO3。
(4)溶液D到固体E过程中需要控制溶液pH=13,如果pH过小,导致铝离子不能完全转化为偏铝酸根离子,正确答案:AI3+不能完全变为偏铝酸根。
(5)pH=13,c(OH-)=0.1mol/L,Ksp=c(Mg2+)×c2(OH-)=5.6×10-12,c(Mg2+)= 5.6×10-10 mol/L,正确答案:5.6×10-10。
II.(1)通过题给信息可知,X、Y均是铜,但X极附近生成砖红色沉淀,说明该极发生了氧化反应,铜在碱性环境下失电子变为Cu2O,极反应为2Cu-2e-+2OH-=Cu2O + H2O;正确答案:2Cu-2e-+2OH-=Cu2O + H2O。
(2)X、Y皆为惰性电极,电解NaCl溶液,总反应为2NaCl+2H2O=2NaOH+Cl2↑+H2↑, Y电极产生氢气560mL(即0.025 mol),根据方程式可知生成NaOH的量为0.05 mol,NaOH溶液的浓度为0.05/0.5=0.1mol/L,c(H+)=10-13 mol/L,B电池溶液的pH=13;电解完成后,从溶液中溢出了氢气和氯气各0.025 mol,要使该溶液恢复到原来的状态,需加入氯化氢气体0.05 mol;正确答案:0.05mol HCI。


科目:高中化学 来源: 题型:
【题目】铅酸蓄电池是常见的化学电源,其电极材料分别是Pb和PbO2,电解质溶液为一定浓度的硫酸。充放电的总反应是: Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O
2PbSO4+2H2O

(1)该蓄电池放电工作时电解质溶液中SO42-移向________(填“正极”或“负极”,下同)充电时,该极接直流电源的_________。
(2)Cu2O是一种半导体材料,可通过右图的电解装置制取,电解总反应为:2Cu+H2O![]() Cu2O+H2↑
Cu2O+H2↑
阴极的电极反应式是__________________________。 若用铅酸蓄电池作为电源进行电解,当蓄电池中有0.2mol H+被消耗时,Cu2O的理论产量为_______g。
(3)为防止钢闸门在水中被腐蚀,可将其与铅酸蓄电池的_______极相连(填Pb或PbO2)。
(4)用铅蓄电池电解500mL饱和食盐水(足量)。电解一段时间后,共收集到气体1120mL(已折算成标准状况下),则所得溶液的pH=_________(不考虑气体的溶解及电解前后溶液体积的变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列四个常用电化学装置的叙述中,正确的是
|
|
|
|
图Ⅰ碱性锌锰电池 | 图Ⅱ铅-硫酸蓄电池 | 图Ⅲ电解精炼铜 | 图Ⅳ银锌纽扣电池 |
A. 图Ⅰ所示电池中,MnO2的作用是催化剂
B. 图Ⅱ所示电池放电过程中,硫酸浓度不断增大
C. 图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D. 图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辣椒素是辣椒的活性成分,可在口腔中产生灼烧感,能够起到降血压和胆固醇的功效,进而在很大程
度上预防心脏病,也能缀解肌肉关节疼痛。辣椒素酯类化合物的结构可以表示为:
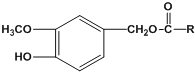
其中一种辣椒素脂类化合物J的合成路线如下:
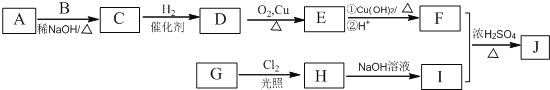
已知:①A、B和E为同系物,其中B的相对分子质量为44,A和B核磁共振氢谱显示都有两组峰
②J的分子式为C15H22O4
③![]()
回答下列问题:
(1)G所含官能团的名称为_______________________。
(2)由A和B生成C的化学方程式为___________________。
(3)由C生成D的反应类型为____________,D的化学名称为________________。
(4)由H生成I的化学方程式为_______________________。
(5)在G的同分异构体中,苯环上的一氯代物只有种的共有_____种(不含立体异构),其中核磁共振氢谱显示两组峰的是__________(写结构简式)。
(6)参照上述路线,设计一条以乙醛为原料(无机试剂任选)合成乙酸正丁酯的路线:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】作为“血迹检测小王子”,鲁米诺反应在刑侦中扮演了重要的角色,其一种合成原理如图所示。下列有关说法正确的是

A. 鲁米诺的化学式为C8H6N3O2
B. 1 mol A分子最多可以与5 mol氢气发生加成反应
C. B中处于同一平面的原子有9个
D. (1)、(2)两步的反应类型分别为取代反应和还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向2 L密闭容器中加入一定量的固体A和气体B,发生反应A(s)+2B(g) ![]() D(g)+E(g)ΔH=Q kJ·mol-1。在T1 ℃时,反应进行到不同时间测得各物质的物质的量如表:
D(g)+E(g)ΔH=Q kJ·mol-1。在T1 ℃时,反应进行到不同时间测得各物质的物质的量如表:
时间(min) 物质的量(mol) | 0 | 10 | 20 | 30 | 40 | 50 |
B | 2.00 | 1.36 | 1.00 | 1.00 | 1.20 | 1.20 |
D | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
E | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
(1)T ℃时,该反应的平衡常数K=____________________________。
(2)30 min后,只改变某一条件,反应重新达到平衡,据表中数据判断改变的条件可能是_____(填编号)。
a.通入一定量的B b.加入一定量的固体A c.适当缩小容器的体积
d.升高反应体系温度 e.同时加入0.2 mol B、0.1 mol D、0.1 mol E
(3)对于该反应,用各物质表示的反应速率与时间的关系示意曲线为下图中的____________(填序号)。
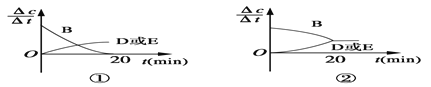

(4)容器的体积和温度T1 ℃不变,向该容器中加入1.60 mol B、0.20 mol D、0.20 mol E和n mol A,达到平衡后,与表格中20分钟时各物质的浓度完全相同,投入固体A的物质的量n的取值范围是______。
(5)若该密闭容器绝热,实验测得B的转化率随温度变化的示意图如图所示。由图可知,Q________0(填“大于”或“小于”),c点v正________v逆(填“大于”、“小于”或“等于”)。
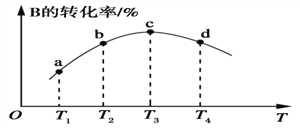
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标况下将CO2气体缓缓地通入到含2 mol KOH、1 mol Ba(OH)2和2 mol KAlO2的混合溶液中直至过量,生成沉淀的物质的量与所通CO2的体积关系如图所示。下列关于整个反应进程中的各种描述正确的是
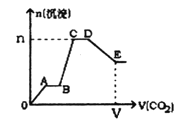
A.A~B段和C~D段发生的反应相同
B.B~C段反应的离子方程式是A1O2-+2H2O+CO2=Al(OH)3↓+HCO3-
C.V=134.4 L,n=3mol
D.D点所得溶液中离子浓度的关系为:c(K+)>c(CO32-)>c(OH﹣)>c(HCO3-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化钛是无色液体,沸点为136℃,极易水解。在800℃下,将氯气通过二氧化钛和炭粉的混合物可制得四氯化钛,同时产生一种有毒气体。装置如下图。
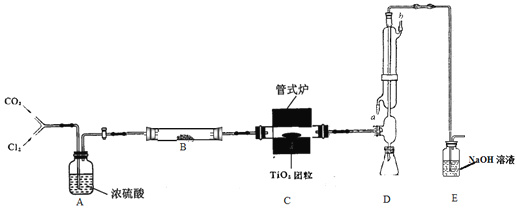
(1)实验步骤:
先将适量TiO2、炭粉混合均匀,制成多孔状TiO2团粒。然后进行如下操作,正确的顺序为____________________(填序号)。
①通入CO2气体并开始加热;
②观察反应已基本完成,停止加热,改通CO2气体直至冷却至室温;
③将TiO2团粒放入瓷管中适当位置,并连接好整套装置;
④当管式炉升温到800℃后改通Cl2,同时在冷凝管中通冷凝水;
⑤取下锥形瓶,立即用塞子塞紧。
实验中不直接使用二氧化钛和炭粉,而是先制成多孔状TiO2团粒的原因是_________。
(2)冷凝管冷凝水的入口为________(填标号)。
(3)装置B所装的药品为_____________,作用为________________;实验中两次通入CO2,其中第二次通入CO2的作用是______________;可用_______气体代替CO2(任填一种)。
(4)以上步骤②,观察到(填现象)________________时,可确定反应已基本完成。
(5)制备反应的主要化学方程式为_________________________________________。
(6)该装置存在明显的缺陷,提出改进措施__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=2的A、B两种酸溶液各lmL,分别加水稀释到1000 mL,其溶液的pH与溶液体积(V)的关系如图所示,则下列说法正确的是( )
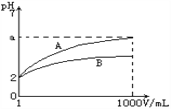
A. A、B两种酸溶液物质的量浓度一定相等
B. 稀释后A酸溶液的酸性比B酸溶液强
C. a=5时,A是强酸,B是弱酸
D. 若A、B都是弱酸,则5≥a>2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com