
ЁОЬтФПЁПЫФТШЛЏюбЪЧЮоЩЋвКЬхЃЌЗаЕуЮЊ136ЁцЃЌМЋвзЫЎНтЁЃдк800ЁцЯТЃЌНЋТШЦјЭЈЙ§ЖўбѕЛЏюбКЭЬПЗлЕФЛьКЯЮяПЩжЦЕУЫФТШЛЏюбЃЌЭЌЪБВњЩњвЛжжгаЖОЦјЬхЁЃзАжУШчЯТЭМЁЃ
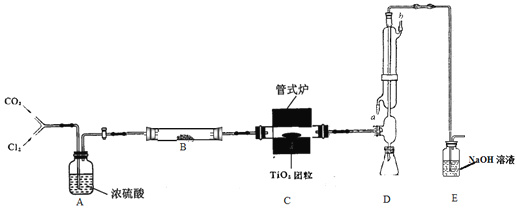
ЃЈ1ЃЉЪЕбщВНжшЃК
ЯШНЋЪЪСПTiO2ЁЂЬПЗлЛьКЯОљдШЃЌжЦГЩЖрПззДTiO2ЭХСЃЁЃШЛКѓНјааШчЯТВйзїЃЌе§ШЗЕФЫГађЮЊ____________________ЃЈЬюађКХЃЉЁЃ
ЂйЭЈШыCO2ЦјЬхВЂПЊЪММгШШЃЛ
ЂкЙлВьЗДгІвбЛљБОЭъГЩЃЌЭЃжЙМгШШЃЌИФЭЈCO2ЦјЬхжБжСРфШДжСЪвЮТЃЛ
ЂлНЋTiO2ЭХСЃЗХШыДЩЙмжаЪЪЕБЮЛжУЃЌВЂСЌНгКУећЬззАжУЃЛ
ЂмЕБЙмЪНТЏЩ§ЮТЕН800ЁцКѓИФЭЈCl2ЃЌЭЌЪБдкРфФ§ЙмжаЭЈРфФ§ЫЎЃЛ
ЂнШЁЯТзЖаЮЦПЃЌСЂМДгУШћзгШћНєЁЃ
ЪЕбщжаВЛжБНгЪЙгУЖўбѕЛЏюбКЭЬПЗлЃЌЖјЪЧЯШжЦГЩЖрПззДTiO2ЭХСЃЕФдвђЪЧ_________ЁЃ
ЃЈ2ЃЉРфФ§ЙмРфФ§ЫЎЕФШыПкЮЊ________ЃЈЬюБъКХЃЉЁЃ
ЃЈ3ЃЉзАжУBЫљзАЕФвЉЦЗЮЊ_____________ЃЌзїгУЮЊ________________ЃЛЪЕбщжаСНДЮЭЈШыCO2ЃЌЦфжаЕкЖўДЮЭЈШыCO2ЕФзїгУЪЧ______________ЃЛПЩгУ_______ЦјЬхДњЬцCO2ЃЈШЮЬювЛжжЃЉЁЃ
ЃЈ4ЃЉвдЩЯВНжшЂкЃЌЙлВьЕНЃЈЬюЯжЯѓЃЉ________________ЪБЃЌПЩШЗЖЈЗДгІвбЛљБОЭъГЩЁЃ
ЃЈ5ЃЉжЦБИЗДгІЕФжївЊЛЏбЇЗНГЬЪНЮЊ_________________________________________ЁЃ
ЃЈ6ЃЉИУзАжУДцдкУїЯдЕФШБЯнЃЌЬсГіИФНјДыЪЉ__________________________________ЁЃ
ЁОД№АИЁП ЂлЂйЂмЂкЂн діДѓЗДгІЮяНгДЅУц a ЮоЫЎСђЫсЭ МьбщзАжУжаЕФЫЎеєЦјЪЧЗёГ§ОЁ НЋЩњГЩЕФTiCl4ЦјЬхЭъШЋХХШыРфФ§ЙмЃЛЗРжЙРфШДЪБЃЌЩеМюШмвКЛђЫЎеєЦјЕЙЮќШызЖаЮЦПжа N2 РфФ§ЙмФЉЖЫУЛгаTiCl4вКЕЮМЬајЕЮЯТ TiO2ЃЋ2CЃЋ2Cl2![]() TiCl4ЃЋ2CO дкзАжУФЉЖЫЃуГіПкДІЃЌЗХвЛеЕЕуШМЕФОЦОЋЕЦ
TiCl4ЃЋ2CO дкзАжУФЉЖЫЃуГіПкДІЃЌЗХвЛеЕЕуШМЕФОЦОЋЕЦ
ЁОНтЮіЁПЗжЮіЃКБОЬтЪЧвЛЕРЮяжЪжЦБИЕФЪЕбщЬтЃЌНтЬтЪБЃЌгІИУЯШЗжЮіЬтФПжаИјГіЕФвЊжЦБИЕФЮяжЪЕФЛљБОаджЪЃЌдйИљОнзАжУЭМЃЌЗжГіУПИізАжУЕФзїгУЃЌНјааНтД№МДПЩЁЃ
ЯъНтЃКЃЈ1ЃЉЪЕбщжагІИУЯШСЌНгзАжУМгШывЉЦЗЃЌЭЈШыЖўбѕЛЏЬМХХГ§зАжУЕФПеЦјЃЌдйЭЈШыТШЦјНјааЗДгІЃЌШЛКѓдкЖўбѕЛЏЬМЦјЬхжаРфШДЃЌзюКѓШћНєШћзгЃЌЗРжЙЫЎНтЁЃЫљвдЫГађЮЊЃКЂлЂйЂмЂкЂнЁЃЯШНЋЪЪСПTiO2ЁЂЬПЗлЛьКЯОљдШЃЌжЦГЩЖрПззДTiO2ЭХСЃЃЌетбљПЩвддіДѓЗДгІЮяЕФНгДЅУцЛ§ЃЌМгПьЗДгІЫйТЪЁЃ
ЃЈ2ЃЉРфФ§ЫЎгІИУЯТПкШыЩЯПкГіЃЌЫљвдШыПкЮЊaЁЃ
ЃЈ3ЃЉзАжУBжагІИУМгШыЮоЫЎСђЫсЭвдбщжЄЫЎеєЦјЖМБЛГ§ШЅЃЛЪЕбщНсЪјКѓЃЌГжајЭЈШыЖўбѕЛЏЬМЕФФПЕФЪЧЮЊСЫЪЙЩњГЩЮядкЖўбѕЛЏЬМЦјСїжаРфШДЃЌЭЌЪБвВНЋПЩФмдкзАжУжаВаСєЕФTiCl4ХХШыDжаЃЌвВФмЗРжЙЧтбѕЛЏФЦШмвКЛђЫЎеєЦјЕЙЮќжСDжаЁЃЪЕбщжаПЩвдЪЙгУШЮвтЕФЖшадЦјЬхДњЬцЖўбѕЛЏЬМЃЌР§ШчЃКЕЊЦјЛђЯЁгаЦјЬхЁЃ
ЃЈ4ЃЉвдЩЯВНжшЂкЃЌЕБЗДгІНсЪјЕФЪБКђЃЌУЛгаTiCl4ЩњГЩСЫЃЌЫљвдDжаРфФ§ЙмЯТЖЫОЭВЛЛсдйгавКЕЮЕЮЯТЁЃ
ЃЈ5ЃЉжЦБИЗДгІЪЧЖўбѕЛЏюбЁЂЬМЗлЁЂТШЦјЗДгІЕУЕНTiCl4КЭгаЖОЦјЬхЃЈCOЃЉЃЌЫљвдЗДгІЮЊЃКTiO2ЃЋ2CЃЋ2Cl2![]() TiCl4ЃЋ2COЁЃ
TiCl4ЃЋ2COЁЃ
ЃЈ6ЃЉИУзАжУДцдкУїЯдЕФШБЯнЪЧЩњГЩЕФCOУЛгаНјааЮВЦјДІРэЃЌЫљвдИФНјДыЪЉЮЊЃКдкзАжУФЉЖЫЃуГіПкДІЃЌЗХвЛеЕЕуШМЕФОЦОЋЕЦЃЌНЋCOШМЩеЮЊЖўбѕЛЏЬМЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЪЕбщЃК Ђй0.1molLЉ1AgNO3ШмвККЭ0.1molLЉ1NaClШмвКЕШЬхЛ§ЛьКЯЕУЕНзЧвКaЃЌЙ§ТЫЕУЕНТЫвКbКЭАзЩЋГСЕэcЃЛ
ЂкЯђТЫвКbжаЕЮМгМИЕЮ0.1molLЉ1KIШмвКЃЌГіЯжЛызЧЃЛ
ЂлЯђГСЕэcжаЕЮМгМИЕЮ0.1molLЉ1KIШмвКЃЌГСЕэБфЮЊЛЦЩЋЃЎ
ЯТСаЗжЮіВЛе§ШЗЕФЪЧ
A. зЧвКaжаДцдкГСЕэШмНтЦНКтЃКAgClЃЈsЃЉ![]() Ag+ЃЈaqЃЉ+ClЉЃЈaqЃЉ
Ag+ЃЈaqЃЉ+ClЉЃЈaqЃЉ
B. ЂлжабеЩЋБфЛЏЫЕУїAgClзЊЛЏЮЊAgI
C. ЪЕбщПЩвджЄУїAgIБШAgClИќФбШм
D. ТЫвКbжаВЛКЌгаAg+
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПI.СђЫсЙЄвЕжаЗЯдќГЦЮЊСђЫсдќЃЌЦфГЩЗжЮЊSiO2ЁЂFe2O3ЁЂAl2O3ЁЂMgOЁЃФГбЇЯАаЁзщЕФЭЌбЇЩшМЦвдЯТЗНАИЃЌНјааСђЫсдќжаН№ЪєдЊЫиЕФЬсШЁЪЕбщЁЃ

вбжЊЃКШмвКpHЃН3.7ЪБЃЌFe3ЃЋвбОГСЕэЭъШЋЃЛвЛЫЎКЯАББЅКЭШмвКжаc(OHЃ)дМЮЊ1ЁС10Ѓ3 molЁЄLЃ1ЁЃ
ЃЈ1ЃЉаДГіAгыЧтбѕЛЏФЦШмвКЗДгІЕФЛЏбЇЗНГЬЪНЃК______________ЁЃ
ЃЈ2ЃЉЩЯЪіСїГЬжаСНДЮЪЙгУЪдМСЂйЃЌЭЦВтЪдМСЂйгІИУЪЧ________ (ЬюзжФИ)ЁЃ
AЃЎЧтбѕЛЏФЦЁЁЁЁЁЁЁЁЁЁЁЁBЃЎбѕЛЏТС CЃЎАБЫЎ DЃЎЫЎ
ЃЈ3ЃЉHжаШмжЪЪЧ________ЁЃ
ЃЈ4ЃЉШмвКDЕНЙЬЬхEЙ§ГЬжаашвЊПижЦШмвКpHЃН13ЃЌШчЙћpHЙ§аЁЃЌПЩФмЕМжТЕФКѓЙћЪЧ_______ЕФЛЏбЇЪН
ЃЈ5ЃЉМЦЫуШмвКFжаЕФc(Mg2ЃЋ)ЃН___________________(25 ЁцЪБЃЌЧтбѕЛЏУОЕФKspЃН5.6ЁС10Ѓ12)ЁЃ
II.ФГЛЏбЇаЫШЄаЁзщгУЯТЭМЫљЪОзАжУНјааЕчЛЏбЇдРэЕФЪЕбщЬНОП.
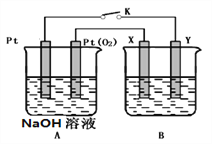
ЃЈ1ЃЉAзАжУЮЊввДМШМСЯЕчГиЃЌШєXЁЂYОљЪЧЭЃЌЕчНтжЪШмвКЮЊNaOHШмвКЃЌЕчГиЙЄзївЛЖЮЪБМфЃЌXМЋИННќЩњГЩзЉКьЩЋГСЕэЃЌВщдФзЪСЯЕУжЊЪЧCu2OЃЌЪдаДГіИУЕчМЋЗЂЩњЕФЕчМЋЗДгІЪНЮЊ___________ЁЃ
ЃЈ2ЃЉШєBЕчГиЕФЕчНтжЪШмвКЮЊ500 mL 1.0mol/LЕФNaClШмвКЃЌXЁЂYНдЮЊЖшадЕчМЋЃЌЕБЕчГиЙЄзївЛЖЮЪБМфЖЯПЊЕчдДKЃЌYЕчМЋга560mLЃЈБъзМзДПіЃЉЮоЩЋЦјЬхЩњГЩЃЈМйЩшЕчМЋВњЩњЦјЬхЭъШЋвчГіЃЌШмвКЬхЛ§ВЛБфЃЉЃЌДЫЪБBЕчГиШмвКЕФpH=_______ЃЌвЊЪЙИУШмвКЛжИДЕНдРДЕФзДЬЌЃЌашМгШы___________ЃЈЬюЮяжЪВЂзЂУїЮяжЪЕФСПЃЉЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПРћгУКЌЭЁЂЬњЕФДжаПжЦБИСђЫсаПМАЯрЙиЮяжЪЁЃЙЄвеСїГЬЭММАгаЙиЪ§ОнШчЯТЃК

ЮяжЪ | Cu(OH)2 | Zn(OH)2 | Fe(OH)3 | ZnS | CuS |
Ksp | 5.0ЁС10Ѓ20 | 2.0ЁС10Ѓ16 | 4.0ЁС10Ѓ38 | 1.2ЁС10Ѓ23 | 8.5ЁС10Ѓ45 |
ЧыЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉДжаПжаЕФЭгыЛьЫсЕФЯЁШмвКЗДгІЕФЛЏбЇЗНГЬЪНЮЊ__________________________ЃЌЭМжаДІРэЦјЬхXвЊФмЙЛЬхЯжТЬЩЋЛЏбЇЫМЯыЃЌЛЙашВЙГфЦјЬх______ЃЈЬюЛЏбЇЪНЃЉЁЃ
ЃЈ2ЃЉШєШмвКIжаc(Cu2ЃЋ)ЮЊ0.05molЁЄLЃ1ЃЌдђШмвКIIжаc(Fe3ЃЋ)ЃО____molЁЄLЃ1ЁЃ
ЃЈ3ЃЉШєЙЬЬхAЪЧZnЃЌШЁ9.61 gЙЬЬхCШмНтгкзуСПЕФ500mL 2 molЁЄLЃ1ЯЁЯѕЫсжаЃЌЙВЪеМЏЕНБъзМзДПіЯТ2.24LЕФЦјЬхЃЌЯђЫљЕУШмвКжаМгШы2 molЁЄLЃ1NaOHШмвКЃЌдђЕБЩњГЩГСЕэзюЖрЪБЃЌГСЕэЕФжЪСПЮЊ_____gЃЛШєЙЬЬхAЪЧСэвЛжжЮяжЪЃЌШЁВПЗжЙЬЬхCгкЪдЙмжаЃЌМгШыбЮЫсВњЩњгаГєМІЕАЮЖЦјЬхЃЌдђИУЗДгІЕФРызгЗНГЬЪНЮЊ________________________ЁЃ
ЃЈ4ЃЉШмвКЂѓОЙ§еєЗЂХЈЫѕЁЂ____________ЁЂЙ§ТЫЁЂЯДЕгЁЂИЩдяЃЌМДЕУЕННЯДПОЛЕФСђЫсаПОЇЬхЃЛШмвКЛЙПЩвджЦБИZnSЃЌЪЕМЪбЁдёЕФЪЧЃЈNH4ЃЉ2SШмвКЖјВЛЪЧNa2SШмвКзїЮЊЗДгІЮяЃЌРэгЩЪЧКѓепжЦЕУЕФZnSКЌгаНЯЖрЕФдгжЪЃЌдђИУдгжЪЪЧ____________ЃЈЬюЛЏбЇЪНЃЉЁЃ
ЃЈ5ЃЉН№ЪєаПГЃгУзїЫсадИЩЕчГиЕФИКМЋЃЌИЩЕчГиВЛЪЙгУЪБЃЌгЩгкИКМЋгыЕчНтжЪШмвКНгДЅЖјЗЂЩњздЗХЕчЗДгІЃК2NH4ЃЋЃЋZnЃН2NH3ЃЋH2ЁќЃЋZn2ЃЋЃЌдьГЩЕчСПздЖЏМѕЩйЁЃаДГіЧІаюЕчГиВЛЪЙгУЪБЃЌЦфе§МЋЩЯЗЂЩњздЗХЕчЕФЛЏбЇЗНГЬЪН__________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГбЇЯАаЁзщбаОПNaOHгыФГаЉЫсжЎМфЕФЗДгІЁЃ
ЂёЃЎжаКЭШШЕФВтЖЈ
дк25ЁцЁЂ101kPaЬѕМўЯТЃЌЧПЫсгыЧПМюЕФЯЁШмвКжаКЭШШПЩБэЪОЮЊЃКH+(aq)+OHЉЄ(aq)=H2O(l) ЁїH=-57.3kJ ЁЄmolЃ1ЁЃАДееЭМ1ЫљЪОзАжУНјааЪЕбщЁЃ
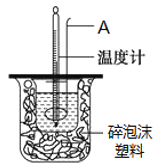
ЃЈ1ЃЉвЧЦїAЕФУћГЦЪЧ________ЁЃ
ЃЈ2ЃЉЫщХнФЫмСЯЕФзїгУЪЧ________ЁЃ
ЃЈ3ЃЉдк25ЁцЁЂ101kPaЬѕМўЯТЃЌШЁ50mL 0.50 molЁЄLЃ1 CH3COOHШмвКЁЂ50mL 0.55 molЁЄLЃ1 NaOHШмвКНјааЪЕбщЃЌВтЕУЕФжаКЭШШЁїH________-57. 3 kJ ЁЄmolЃ1ЃЈЬюЁАЃОЁБЁА=ЁБЛђЁАЃМЁБЃЉЃЌдвђЪЧ ________ЁЃ
ЂђЃЎжаКЭЕЮЖЈ
ЃЈ1ЃЉгУ_______СПШЁ20.00 mLД§ВтЯЁбЮЫсШмвКЗХШызЖаЮЦПжаЃЌВЂЕЮМг1ЁЋ2ЕЮЗгЬЊзїжИЪОМСЃЌгУ0.20 molЁЄLЁЊ1NaOHБъзМШмвКНјааЕЮЖЈЁЃЮЊСЫМѕаЁЪЕбщЮѓВюЃЌИУЭЌбЇвЛЙВНјааСЫШ§ДЮЪЕбщЃЌМйЩшУПДЮЫљШЁЯЁбЮЫсЬхЛ§ОљЮЊ20.00 mLЃЌШ§ДЮЪЕбщНсЙћМЧТМШчЯТЃК
ЪЕбщДЮЪ§ | ЕквЛДЮ | ЕкЖўДЮ | ЕкШ§ДЮ |
ЯћКФNaOHШмвКЬхЛ§/mL | 19.00 | 23.00 | 23.02 |
ИУбЮЫсЕФХЈЖШдМЮЊ________ (БЃСєСНЮЛгааЇЪ§зж)ЁЃЕЮЖЈДяЕНжеЕуЕФБъжОЪЧ________ЁЃ
ЃЈ2ЃЉШєФГДЮЕЮЖЈНсЪјЪБЃЌЕЮЖЈЙмвКУцШчЭМ2ЫљЪОЃЌдђжеЕуЖСЪ§ЮЊ________mLЁЃ

ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЯрЙиЪЕбщЕФа№ЪіжаЃЌе§ШЗЕФЪЧ(ЁЁЁЁ)
A. HClOЁЂЛюадЬПОљФмЪЙФГаЉгаЩЋЮяжЪЭЪЩЋЃЌЫЕУїЖўепОљгабѕЛЏад
B. МгШШЗжБ№ЪЂгаNaHCO3КЭЕтЕФСНжЇЪдЙмЃЌЪдЙмЕзВПЙЬЬхОљМѕЩйЃЌЫЕУїЖўепОљЗЂЩњЩ§ЛЊ
C. гУлсліЧЏМазЁвЛаЁПщгУЩАжНзаЯИДђФЅЙ§ЕФТСВдкОЦОЋЕЦЩЯМгШШЃЌШлЛЏКѓЕФвКЬЌТСЕЮТфЯТРД
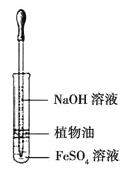
D. гУЩЯЭМзАжУЙлВь Fe(OH)2 ЕФЩњГЩ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЩшNAЮЊАЂЗќМгЕТТоГЃЪ§ЕФжЕЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧ
A. БъзМзДПіЯТЃЌ2.24Lе§ЮьЭщжаКЌгаЕФЬМдзгЪ§ЮЊ0.5 NA
B. 1L0.1molЁЄL-1NaHCO3ШмвКжаЫљКЌHCO3-ЕФЪ§ФПЮЊ0.1NA
C. вЛЖЈЬѕМўЯТЃЌ0.1mol COгы0.1mol H2O(g)ГфЗжЗДгІЃЌЩњГЩH2ЕФЗжзгЪ§ЮЊ0.1NA
D. дкЗДгІЃК3FeS2+12C+8O2=Fe3O4+12CO+6SжаЃЌУПЩњГЩ0.6molSЃЌзЊвЦЕФЕчзгЪ§ЮЊ3.2NA
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП25ЁцЪБЃЌЯђ10 mL 0.1 molЁЄLЃ1 H2AШмвКжаЕЮМгЕШХЈЖШЕФNaOHШмвКЃЌШмвКЕФpHгыNaOHШмвКЕФЬхЛ§ЙиЯЕШчЭМЫљЪОЁЃЯТСаа№ЪіДэЮѓЕФЪЧ

A. CЕуШмвКжаКЌгаNaHAКЭNa2A
B. NaHAШмвКжаЫЎЕФЕчРыГЬЖШБШNa2AШмвКжааЁ
C. BЕуЃЌc (NaЃЋ)ЃН2[c (H2A)ЃЋc (HA)ЃЋc (A2Ѓ)]
D. DЕуЃЌc (NaЃЋ)ЃОc (A2Ѓ)ЃОc (OHЃ)ЃОc (HAЃ)ЃОc (HЃЋ)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП84ЯћЖОвК(гааЇГЩЗжЪЧДЮТШЫсФЦ)ЁЂЦЏАзЗл(гааЇГЩЗжЪЧДЮТШЫсИЦ)ЕШЮяжЪЪЧШеГЃЩњЛюжаГЃгУЕФЯћЖОМСЃЌЙуЗКгІгУгкШеГЃЩњЛюжаЁЃИљОнЯТСавЊЧѓЛиД№ЯрЙиЮЪЬтЃК
(1)дк0.1 molЁЄLЃ1ЕФ84ЯћЖОвКжаЕЮМгМИЕЮЗгЬЊЪдвКЃЌПЩФмЙлВьЕНЕФЯжЯѓЪЧ______________ЃЌаДГіЗДгІЕФРызгЗНГЬЪНЃК______________________________ЁЃ
(2)ФГЭЌбЇВтЖЈЦЏАзЗлШмвКpHЕФВйзїЗНЗЈЃКНЋвЛаЁПщpHЪджНЗХдкБэУцУѓЩЯЃЌгУВЃСЇАєеКШЁЩйСПД§ВтвКЕЮдкЪджНЩЯЃЌДѓдМАыЗжжгКѓЃЌдйгыБъзМБШЩЋПЈЖдееЁЃФуШЯЮЊЫћФмЗёДяЕНЪЕбщФПЕФЃП________(ЬюЁАФмЁБЛђЁАЗёЁБ)ЁЃ
(3)ЯТСаЙигк0.5 molЁЄLЃ1 NaClOШмвКжаИїСЃзгХЈЖШЕФЙиЯЕЪНе§ШЗЕФЪЧ____________ЁЃ
AЃЎc(OHЃ)>c(HЃЋ)>c(NaЃЋ)>c(ClOЃ) BЃЎc(NaЃЋ)ЃНc(ClOЃ)ЃЋc(HClO)
CЃЎc(NaЃЋ)>c(ClOЃ)>c(OHЃ)>c(HЃЋ) DЃЎc(NaЃЋ)ЃЋc(HЃЋ)ЃНc(ClOЃ)
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com