
【题目】实验: ①0.1molL﹣1AgNO3溶液和0.1molL﹣1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;
②向滤液b中滴加几滴0.1molL﹣1KI溶液,出现浑浊;
③向沉淀c中滴加几滴0.1molL﹣1KI溶液,沉淀变为黄色.
下列分析不正确的是
A. 浊液a中存在沉淀溶解平衡:AgCl(s)![]() Ag+(aq)+Cl﹣(aq)
Ag+(aq)+Cl﹣(aq)
B. ③中颜色变化说明AgCl转化为AgI
C. 实验可以证明AgI比AgCl更难溶
D. 滤液b中不含有Ag+
科目:高中化学 来源: 题型:
【题目】一种用软锰矿(主要成分MnO2)和黄铁矿(主要成分FeS2) 制取MnSO4·H2O并回收单质硫的工艺流程如下:
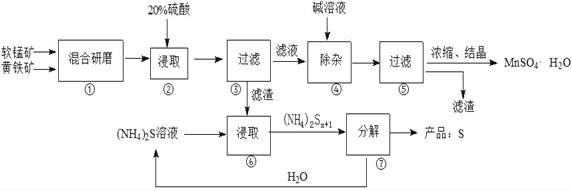
已知:本实验条件下,高锰酸钾溶液与硫酸锰溶液混合产生二氧化锰。
回答下列问题:
(1)步骤①混合研磨成细粉的主要目的是_____________________________________________;步骤②浸取时若生成S、MnSO4及Fe2(SO4)3的化学方程式为_____________________________________。
(2)步骤③所得酸性滤液可能含有Fe2+,为了除去Fe2+可先加入______________________;步骤④需将溶液加热至沸然后在不断搅拌下加入碱调节pH为4~5,再继续煮沸一段时间,“继续煮沸”的目的是_____________________________________。步骤⑤所得滤渣为__________________(填化学式)。
(3)步骤⑦需在90~100℃下进行,该反应的化学方程式为_________________________________。
(4)测定产品MnSO4·H2O的方法之一是:准确称取a g产品于锥形瓶中,加入适量ZnO及H2O煮沸,然后用c mol·L-1KMnO4标准溶液滴定至浅红色且半分钟不褪色,消耗标准溶液VmL,产品中Mn2+的质量分数为w(Mn2+)=________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅酸蓄电池是常见的化学电源,其电极材料分别是Pb和PbO2,电解质溶液为一定浓度的硫酸。充放电的总反应是: Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O
2PbSO4+2H2O

(1)该蓄电池放电工作时电解质溶液中SO42-移向________(填“正极”或“负极”,下同)充电时,该极接直流电源的_________。
(2)Cu2O是一种半导体材料,可通过右图的电解装置制取,电解总反应为:2Cu+H2O![]() Cu2O+H2↑
Cu2O+H2↑
阴极的电极反应式是__________________________。 若用铅酸蓄电池作为电源进行电解,当蓄电池中有0.2mol H+被消耗时,Cu2O的理论产量为_______g。
(3)为防止钢闸门在水中被腐蚀,可将其与铅酸蓄电池的_______极相连(填Pb或PbO2)。
(4)用铅蓄电池电解500mL饱和食盐水(足量)。电解一段时间后,共收集到气体1120mL(已折算成标准状况下),则所得溶液的pH=_________(不考虑气体的溶解及电解前后溶液体积的变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
①增加水的量或温度,都可以加快镁跟水的反应速率。
②增加硫酸的浓度,一定可以加快锌与硫酸反应制取氢气的速率。
③对反应3H2(g) + N2(g) ![]() 2NH3(g),在一密闭容器中进行,充入氦气,则化学反应速率一定不改变。
2NH3(g),在一密闭容器中进行,充入氦气,则化学反应速率一定不改变。
④对于反应3KSCN(aq) + FeCl3(aq)![]() Fe(SCN)3(aq)+ 3KC l(aq),加入KCl固体,逆反应速率瞬时增大,随后正反应速率增大
Fe(SCN)3(aq)+ 3KC l(aq),加入KCl固体,逆反应速率瞬时增大,随后正反应速率增大
A. ①② B. ①④ C. ②④ D. 无
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是电解CuCl2溶液的装置,其中c、d为石墨电极,则下列有关判断正确的是( )
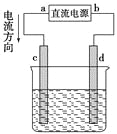
A. a为负极,b为正极
B. a为阳极,b为阴极
C. 电解过程中,d电极质量增加
D. 电解过程中,氯离子浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列四个常用电化学装置的叙述中,正确的是
|
|
|
|
图Ⅰ碱性锌锰电池 | 图Ⅱ铅-硫酸蓄电池 | 图Ⅲ电解精炼铜 | 图Ⅳ银锌纽扣电池 |
A. 图Ⅰ所示电池中,MnO2的作用是催化剂
B. 图Ⅱ所示电池放电过程中,硫酸浓度不断增大
C. 图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D. 图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辣椒素是辣椒的活性成分,可在口腔中产生灼烧感,能够起到降血压和胆固醇的功效,进而在很大程
度上预防心脏病,也能缀解肌肉关节疼痛。辣椒素酯类化合物的结构可以表示为:
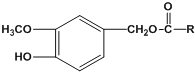
其中一种辣椒素脂类化合物J的合成路线如下:
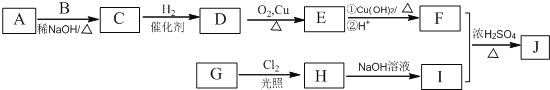
已知:①A、B和E为同系物,其中B的相对分子质量为44,A和B核磁共振氢谱显示都有两组峰
②J的分子式为C15H22O4
③![]()
回答下列问题:
(1)G所含官能团的名称为_______________________。
(2)由A和B生成C的化学方程式为___________________。
(3)由C生成D的反应类型为____________,D的化学名称为________________。
(4)由H生成I的化学方程式为_______________________。
(5)在G的同分异构体中,苯环上的一氯代物只有种的共有_____种(不含立体异构),其中核磁共振氢谱显示两组峰的是__________(写结构简式)。
(6)参照上述路线,设计一条以乙醛为原料(无机试剂任选)合成乙酸正丁酯的路线:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化钛是无色液体,沸点为136℃,极易水解。在800℃下,将氯气通过二氧化钛和炭粉的混合物可制得四氯化钛,同时产生一种有毒气体。装置如下图。
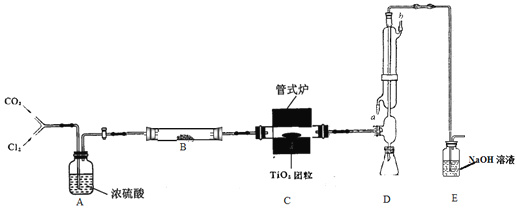
(1)实验步骤:
先将适量TiO2、炭粉混合均匀,制成多孔状TiO2团粒。然后进行如下操作,正确的顺序为____________________(填序号)。
①通入CO2气体并开始加热;
②观察反应已基本完成,停止加热,改通CO2气体直至冷却至室温;
③将TiO2团粒放入瓷管中适当位置,并连接好整套装置;
④当管式炉升温到800℃后改通Cl2,同时在冷凝管中通冷凝水;
⑤取下锥形瓶,立即用塞子塞紧。
实验中不直接使用二氧化钛和炭粉,而是先制成多孔状TiO2团粒的原因是_________。
(2)冷凝管冷凝水的入口为________(填标号)。
(3)装置B所装的药品为_____________,作用为________________;实验中两次通入CO2,其中第二次通入CO2的作用是______________;可用_______气体代替CO2(任填一种)。
(4)以上步骤②,观察到(填现象)________________时,可确定反应已基本完成。
(5)制备反应的主要化学方程式为_________________________________________。
(6)该装置存在明显的缺陷,提出改进措施__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com