
【题目】下列溶液中溶质的物质的量浓度为1mol/L的是
A. 将40gNaOH溶解于1L水中 B. 将22.4L氯化氢气体溶于水配成1L溶液
C. 将1L 10mol/L的浓盐酸与9L水混合 D. 10gNaOH溶解在水中配成250mL溶液
科目:高中化学 来源: 题型:
【题目】将绿豆大小的金属钠投入加有酚酞的100mL蒸馏水中,则
A. 溶液变蓝 B. Na浮在水面上并熔化成小球
C. Na在水面上游动 D. 有H2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量。经测定,加入的NaOH的物质的量(mol)和所得沉浮的物质的量(mol)的关系如右图所示。则:
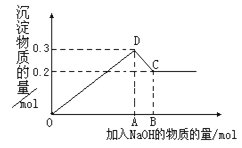
(1)写出代表各线段发生反应的离子方程式:
OD段______________________________,
DC段______________________________。
(2)原溶液中Mg2+、Al3+物质的量浓度之比为___________。
(3)图中C点表示当加入_______mol NaOH时,Al3+已经转化成____________。
(4)图中线段OA∶AB=__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类合理的是
A. 氧化物:CO2、NO、SO2、H2O
B. 碱:NaOH、KOH、Ba(OH)2、Na2CO3
C. 铵盐:NH4Cl、NH4NO3、(NH4)2SO4、NH3·H2O
D. 碱性氧化物:Na2O、CaO、Mn2O7、Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子反应在许多领域都有广泛应用,理解离子反应的本质有重要意义。请回答下列问题:
(1)将硫酸锰与K2S2O8溶液在常温下混合,能慢慢得到二氧化锰(MnO2)。请写出该反应的离子方程式_________________。
(2)已知某溶液中可能含有NO3-、Cl-、SO42-、CO32-、NH4+ 、Fe3+、Al3+和K+中的几种,且所含阴离子的物质的量相等。为确定该溶液的成分,某学习小组做了如下实验:
①取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;②将沉淀过滤、洗涤、灼烧,得到1.6g固体;③向上述滤液中加入足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。
则该溶液中的阳离子为________________、阴离子为_______________。
(3)常温下Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16,则常温条件下,将饱和的AgCl溶液和饱和的AgI溶液等体积混合,________(填“会”或“不会”)有沉淀生成。
(4)pH相同的①NH4Cl ②NH4Al(SO4)2 ③(NH4)2SO4三种溶液的c(NH4+ )由大到小顺序为________________(用序号及“>”“=”“<”表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代就有湿法炼铜的记载“曾青得铁则化为铜”,反应为Fe+CuSO4=Cu+FeSO4。有关该反应的说法正确的是
A.Fe是氧化剂 B.CuSO4是还原剂
C.Fe被氧化 D.CuSO4发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焊接钢铁时常用的焊药为氯化铵,其作用是消除焊接处的铁锈。发生的反应体系中共有六种物质:NH4Cl、N2、Fe2O3、Fe 和 X。
(1)根据题意,可判断出X是_____________(写化学式)
(2)写出并配平该反应的化学方程式,并用双线桥标出电子转移的方向和数目:________________。
(3)在反应 3BrF3+5H2O=HBrO3+Br2+9HF+O2 中,被氧化的元素是____________,当有5 mol水反应时,由H2O还原的BrF3为______________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于N2(g)+3H2(g)![]() 2NH3(g) △H1KJ/mol,满足如下图像:
2NH3(g) △H1KJ/mol,满足如下图像:

(1)根据图判断△H1 0,T3 T4。(填“>”“<”“=”)
(2)若温度为T1且容器为2L的密闭容器下中,发生合成氨的反应,起始时通入2mol的N2和6mol的H2,10分钟达到平衡状态,此时NH3的体积分数为60%。则0到10min内用H2表示化学反应速率为_________mol/(L·min),N2的转化率为___________,反应开始和平衡状态体系的压强之比等于___________。
(3)若第(2)小问中反应体系达到平衡后,再通入1molN2和3mol的H2,则H2的转化率为___________(填“增大”“减小”或“不变”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com