
【题目】(1)写出下列化合物的名称或结构简式:
① _______________________________,
_______________________________,
②CH2=C(CH3)CH=CH2_______________________________,
③CH2=CHCOOH _______________________________,
④2,5-二甲基-2,4-己二烯的结构简式:_________________________________。
(2)麻黄素又称黄碱,是我国特定的中药材麻黄中所含有的一种生物碱,经我国科学家研究发现其结构如图:

①麻黄素中含氧官能团的名称是_________________,属于____________类(填“醇”或“酚”)。
②下列各物质:
A. 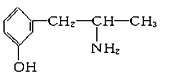 B.
B. 
C.  D.
D. 
E. 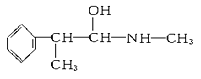
与麻黄素互为同分异构体的是________(填字母,下同),互为同系物的是________。
【答案】 2,4,5,7,7—五甲基—3,3,4—三乙基辛烷 2—甲基—1,3—丁二烯 丙烯酸 ![]() 羟基 醇 D、E C
羟基 醇 D、E C
【解析】(1)①由该有机物的结构简式及烷烃命名的“长多近简小”原则可得:主链上有8个碳原子,另有8个取代基,从左侧编号,答案为:2,4,5,7,7-五甲基-3,3,4-三乙基辛烷。②CH2=C(CH3)CH=CH2:该有机物主链为1,3-丁二烯,在2号C上有一个甲基,故命名为:2-甲基-1,3-丁二烯。③CH2=CHCOOH属于羧酸,共含3个C,含有碳碳双键,故命名为丙烯酸。④2,5-二甲基-2,4-己二烯,主链为6个C的二烯烃,2号C和4号C上有双键,2号C和5号C上分别有1个甲基,故结构简式为:![]() 。
。
(2)①麻黄素中含氧官能团为羟基,可看成醇类物质,故答案为:羟基;醇;②分子式相同而结构不同的有机物互称同分异构体,结构相似组成相差一个或若干个“-CH2-”的有机物互为同系物;麻黄素分子式为C10H15NO,A分子式为C9H13NO,但与麻黄素结构不相似;B分子式为C11H17NO,但与麻黄素结构不相似;C分子式为C9H13NO,与麻黄素结构相似,分子组成相差1个“-CH2-”,互为同系物;D分子式为C10H15NO,与麻黄素结构不同,互为同分异构体;E分子式为C10H15NO,与麻黄素结构不同,互为同分异构体;故答案为:DE;C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】图1为铁在一定条件下的转化关系图。

请回答:
(1)“曾青得铁则化为铜”的反应有:Fe + CuSO4 = FeSO4 + Cu,该反应的还原剂是_____________(填化学式);
(2)工业上,向500-600℃的铁屑中通入Cl2生产FeCl3,向FeCl3溶液中滴加KSCN溶液,观察到的现象是溶液变成____________色;
(3)图2为原电池装置示意图,此装置可以把化学能转化为_________能,其中铁作_____极;

(4)Fe3O4中Fe既有+2价又有+3价,则+2价和+3价Fe的个数比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】法国里昂的科学家最近发现一种只由四个中子构成的微粒,这种微粒称为“四中子”,也有人称之为“零号元素”。下列有关“四中子”微粒的说法不正确的是
A.该微粒不显电性 B.该微粒质量数为4
C.与氢元素的质子数相同 D.该微粒质量比氢原子大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)制备Cu2(OH)2CO3,其工艺流程如下:
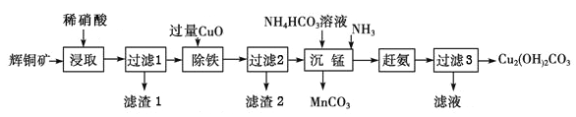
(1)“酸浸”过程中,将矿石粉碎,其目的是__________;加热能加快矿石粉“酸浸”速率,但温度不宜过高,其原因是__________。
(2)Cu2S和硝酸反应,其还原产物为NO。已知1 mol Cu2S完全反应时转移10 mol电子。写出该反应的离子方程式:_____________________。
(3)“除铁”中加入过量氧化铜发生反应的离子方程式为___________________。
(4)从过滤3得到的滤液中可提取一种肥料,它的化学式为__________;滤渣1的主要成分是__________(填化学式)。
(5)设计实验确认过滤2得到的滤液中是否有Fe3+:___________________________。
(6)取wg辉铜矿经上述流程转化,加入agCuO,滤渣2含bgCuO,最终得cmolCu2(OH)2CO3不考虑铜元素损失)。原辉铜矿含Cu2S的质量分数为____________。(用代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素X气态氢化物与该元素最高价氧化物的水化物反应生成盐,则该元素不可能具有的性质是.
A. 在周期表中处于第3周期VIIA B. 在周期表中处于第2周期VA族
C. 氢化物比PH3稳定 D. 常见化合价有-3、+2、+3、+5价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1.92 g Cu和一定量的浓HNO3反应,随Cu不断减少,反应生成气体的颜色逐渐变浅,当Cu 完全消耗时,共收集到气体1.12 L(标况),反应中消耗HNO3物质的量为( )
A. 无法计算 B. 0.11 mol C. 0 .65 mol D. 0.8 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】容积固定的密闭容器中,充入一定体积的CO2和H2,发生反应:CO2(g)+3H2(g)![]() CH3OH (g)+H2O(g)。测得不同温度下CO2的物质的量随时间变化如右图。下列说法正确的是( )
CH3OH (g)+H2O(g)。测得不同温度下CO2的物质的量随时间变化如右图。下列说法正确的是( )

A. 该反应为吸热反应
B. T1、T2对应的平衡常数K1>K2
C. T1时,图中A点的正反应速率小于逆反应速率
D. T2时,若上述反应在压强恒定的密闭容器中进行,达平衡的时间变短
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)是一种新型、高效的水处理剂,与水反应的化学方程式为:4Na2FeO4+10H2O=4Fe(OH)3+3O2↑+8NaOH。电解制备 Na2FeO4 装置示意图如下。

(1)a是电源的______________极(填“正”或“负”)。电解时,石墨电极附近溶液的碱性____________(填“增强”、“减弱”或“不变”)。
(2)铁电极的反应式为__________________________。
(3)维持一定的电流强度和电解温度,NaOH起始浓度对Na2FeO4浓度影响如下图(电解液体积相同情况下进行实验)。

①电解3.0h内,随NaOH起始浓度增大,Na2FeO4浓度变化趋势是______________(填“增大”、“不变”或“减小”)。
②当NaOH起始浓度为16mol·L-1,1.0~2.0h内生成Na2FeO4的速率是_____________mol·L-1·h-1。
③A 点与B 点相比,n[Fe(OH)3]: A_____________B (填“>”、 “=”或“<” )
(4)提纯电解所得Na2FeO4,采用重结晶、过滤、洗涤、低温烘干的方法,则洗涤剂最好选用______________溶液(填标号)和异丙醇。
A.Fe(NO3)3 B.NH4Cl C.CH3COONa
(5)次氯酸钠氧化法也可以制得Na2FeO4。
己知 2H2(g)+O2(g)=2H2O (1) △H=akJ·mol-1
NaCl(aq)+ H2O(1)=NaClO(aq)+H2(g) △H=bkJ·mol-1
4Na2FeO4(aq)+10H2O(1)=4Fe(OH)3(s)+3O2(g)+8NaOH(aq) △H=c kJ·mol-1
反应 2Fe(OH)3(s)+3NaClO(aq)+4NaOH(aq)=2Na2FeO4(aq)+3NaCl(aq)+5H2O(1)的△H=______________ kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)Cu位于元素周期表第IB族。元素基态原子3d能级上有__________种不冋运动状态的电子;Cu2+的核外电子排布式为______________________
(2)下图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为__________。

(3)胆矾CuSO4·5H2O可写成[Cu(H2O)]SO4·H2O,其结构示意图如图,下列说法正确的是______(填字母)。

A.在上述结构示意图中,所有氧原子都采用sp3杂化
B.在上述结构示意图中,存在配位键、共价键和离子键
C.胆矾是分子晶体,分子间存在氢键
D.胆矾中的水在不同温度下会分步失去
(4)S、H、O三种元素的电负性由小到大的顺序是________________。
(5)往硫酸铜溶液中加入过量氨水,首先形成蓝色沉淀,继续添加氨水,沉淀溶解,得到深蓝色透明溶液,可生成[Cu(NH3)4]2+配离子。写出沉淀转化为深蓝色溶液的的离子方程式__________________;已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是_______________________。
(6)Cu2O的熔点比Cu2S的____________(填“高”或“低”),请解释原因____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com