
【题目】关于下列各图的叙述,正确的是
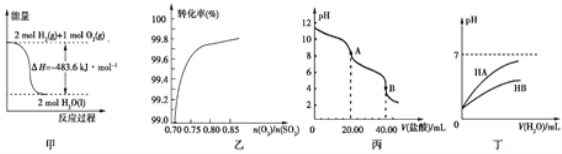
A. 图甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6 kJ·mol-1
B. 图乙表示反应2SO2(g)+O2(g)![]() 2SO3(g)在其他条件不变时,O2的转化率随
2SO3(g)在其他条件不变时,O2的转化率随![]() 的变化关系
的变化关系
C. 图丙表示用0.100 0 mol·L-1的盐酸滴定20.00 mL 0.100 0 mol·L-1Na2CO3溶液的曲线,从A点到B点反应的离子方程式为:CO32-+2H+![]() CO2↑+H2O
CO2↑+H2O
D. 图丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液的pH随加水量的变化,则同浓度溶液的pH:NaA<NaB
 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,反应![]() ,在密闭容器中达到平衡状态,下列说法正确的是( )
,在密闭容器中达到平衡状态,下列说法正确的是( )
A.体积不变,加少许![]() 化学平衡正向移动,再达到平衡状态时与原平衡相比颜色变深
化学平衡正向移动,再达到平衡状态时与原平衡相比颜色变深
B.加压时(体积变小),将使正反应速率增大,逆反应速率减慢
C.体积不变,加少许![]() ,化学平衡逆向移动,再达到平衡状态时与原平衡相比颜色变浅
,化学平衡逆向移动,再达到平衡状态时与原平衡相比颜色变浅
D.保持体积不变,升高温度,化学平衡正向移动,再达到平衡状态时混合气体密度变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 氢氧化钡溶液中加入硫酸铵:Ba2++OH-+NH4++SO42-=BaSO4↓+NH3·H2O
B. 用惰性电极电解CuCl2溶液:Cu2++2Cl-+2H2O![]() Cu(OH)2↓+H2↑+Cl2↑
Cu(OH)2↓+H2↑+Cl2↑
C. 向漂白粉溶液中通入少量二氧化硫:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
D. 向苯酚钠溶液中通入少量的CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下面三个数据:7.2×10-4、4.6×10-4、4.9×10-10分别是下列有关的三种酸的电离常数,若已知下列反应可以发生:
NaCN+HNO2![]() HCN+NaNO2 NaCN+HF
HCN+NaNO2 NaCN+HF![]() HCN+NaF NaNO2+HF
HCN+NaF NaNO2+HF![]() HNO2+NaF
HNO2+NaF
由此可判断下列叙述不正确的是
A.K(HF)=7.2×10-4B.K(HNO2)=4.9×10-10
C.根据两个反应即可得出结论D.K(HCN)<K(HNO2)<K(HF)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应原理的应用,不正确的是( )
A.Al3++3H2O![]() Al(OH)3+3H+ 明矾净水
Al(OH)3+3H+ 明矾净水
B.用化学平衡移动原理能解释加催化剂,使N2和H2在一定条件下转化为NH3
C.TiCl4+(x+2)H2O(过量)![]() TiO2·xH2O↓+4HCl 制备TiO2粉末
TiO2·xH2O↓+4HCl 制备TiO2粉末
D.CO32-+H2O![]() HCO3-+OH-用热的碱溶液清洗油污
HCO3-+OH-用热的碱溶液清洗油污
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下用0.1000mol/L的盐酸分别逐滴加入到20.00mL0.1000 mo1/L的三种一元碱MOH、XOH、YOH溶液中,溶液的pH随加入盐酸体积的变化如图所示。 下列说法不正确的是
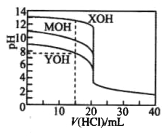
A. XOH为强碱,MOH、YOH均 为弱碱
B. V(HCl)=15.00mL时,三份溶液中离子总浓度大小顺序: XOH>MOH>YOH
C. 当盐酸滴加至20.00 mL时,三条曲线刚好相交
D. 在逐滴加入盐酸至40.00mL的过程中,三份溶液中水的电离程度均先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物是形成光化学烟雾和酸雨的重要原因。人们研究了诸多有关氮氧化物的性质,请回答下列问题:
(1)处理NOx的一种方法是利用甲烷催化还原NOx。
CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) K1
CH4 (g)+2NO2(g) = N2 (g)+CO2(g)+2H2O(g) K2
CH4 (g)+4NO(g) = 2N2 (g)+CO2(g)+2H2O(g) K3
K1、K2、K3依次为三个反应的平衡常数,则K3=____________(用K1、K2表示)
(2)在恒容密闭容器中通入等物质的量的CO和NO,在一定条件下发生反应:2CO(g)+2NO(g)![]() N2(g)+2CO2 (g),测得NO的平衡转化率与温度及压强的关系如图所示:
N2(g)+2CO2 (g),测得NO的平衡转化率与温度及压强的关系如图所示:

①则该反应的△H ________0(填“﹤”“﹥”或“=”)。
②对于气相反应,用某组分(B)的平衡分压强 p(B)代替物质的量浓度 c(B) 也可表示平衡常数kp,如果p1 =1.65MPa,求a点的平衡常数kp =_________(MPa)1 (结果保留 3 位有效数字,分压=总压×物质的量分数)。
(3)利用电化学原理,将NO2、O2和熔融的KNO3制成燃料电池,模拟工业电解法来处理含Cr2O72的废水,如图所示;电解过程中溶液发生反应:Cr2O72+6Fe2++14H+=2Cr3++6Fe3+ +7H2O。

①甲电池工作时,Y是气体,可循环使用。则石墨I附近发生的电极反应式为________。乙池中的pH________(填“变大”“变小”或“不变”)。
②工作时,在相同条件下,甲池内消耗的O2和NO2的体积比为____________。
(4)已知H3PO4为三元酸,Ka1=7.0×103mol·L1,Ka2=6.2×108 mol·L1,Ka3=4.5×1013mol·L 1。则 Na2HPO4水溶液呈________(填“酸”、“中”、“碱”)性,用Ka与Kh的相对大小,说明判断理由_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜和镁的合金4.6g完全溶于浓硝酸,若反应中硝酸被还原只产生4480mL的NO2气体和336mL的N2O4气体(都已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为 ( )
A.9.02gB.8.26gC.8.51gD.7.04g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小
B.物质的溶解度随温度的升高而增加,故物质的溶解都是吸热的
C.沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全
D.除去溶液中Mg2+,用OH-比![]() 效果好,说明Mg(OH)2的溶解度比MgCO3小
效果好,说明Mg(OH)2的溶解度比MgCO3小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com