
【题目】将铁、铝的混合物加入到足量氢氧化钠溶液中,充分反应后过滤,再将过滤得到的固体加入到足量的硫酸铜溶液中,充分反应后过滤得到的固体质量正好与原固体质量相等,则原固体中铝的质量分数为( )
A. 14.3% B. 12.5% C. 87.5% D. 无法计算
【答案】B
【解析】
将铁、铝的混合物加入到足量的NaOH溶液中,反应后剩余固体为Fe,再将过滤得到的固体Fe加入到足量的CuSO4溶液中,会置换出Cu,充分反应后过滤得到的固体Cu的质量恰好与原固体质量相等,说明反应Fe+CuSO4═FeSO4+Cu中Fe完全时固体质量增重等于原混合物中Al的质量,假设固体增重为8g,结合差量法计算混合物中铁的质量,然后计算出铝的质量分数。
得到的固体Cu的质量恰好与原固体质量相等,说明反应Fe+CuSO4═FeSO4+Cu中Fe完全反应时固体质量增重等于原混合物中Al的质量,假设固体增重为8g,则混合物中Al的质量也是8g,
设混合物中Fe的质量为x,则:
Fe+CuSO4═FeSO4+Cu 质量增重
56 6456=8
x 8g
故x = 8g×56/8 = 56 g
则混合物中Al的质量分数为![]() ×100% = 12.5%
×100% = 12.5%
答案选B。


科目:高中化学 来源: 题型:
【题目】下列反应中![]() H>0,
H>0,![]() S>0的是
S>0的是
A. 2Mg(s) + CO2(g)→ 2MgO(s) + C(s)
B. 低温下能自发进行的反应:NH3(g)+HCl(g) →NH4Cl(s)
C. 高温下能自发进行的反应:SiO2(s) +2C(s) →Si(s)+2CO(g)
D. 任何温度下均能自发进行的反应:2H2O2(l) → 2H2O(l) + O2(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,铁与水并不起反应,但在高温下,铁与水蒸气可发生反应。 应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“铁与水蒸气的反应实验”。

请回答该实验中的问题。
(1)写出该反应的反应方程式:__________________________________;并指明该氧化还原反应的还原剂是____________,氧化剂是______________。
(2)实验前必须对整套装置进行气密性检查,操作方法是_______________________________。
(3)圆底烧瓶中盛装有水,该装置受热后的主要作用是____________________________;烧瓶底部放置了几片碎瓷片,碎瓷片的作用是__________________。
(4)酒精灯和酒精喷灯点燃的顺序是__________________________________,为什么?___________________________________________________________________。
(5)干燥管中盛装的物质是________________________,作用是_______________________。
(6)试管中收集的气体是__________,如果要在A处玻璃管处点燃该气体,则必须对该气体进行____________________,方法是________________________________。这一操作的目的是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃类化合物A的相对分子质量为84,分子中含有碳碳双键,且分子中只有一种类型的氢。
(1)A的结构简式为____________________。
(2)在下图中,D1、D2互为同分异构体,E1、E2互为同分异构体。

C的化学名称是_______________;E2的结构简式是_______________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:N2(g)+O2(g)![]() 2NO(g),△H=+180.50 kJ·mol-1;△S=247.7 J·mol-1·K-1。若该反应在一密闭容器中进行,若不考虑温度对该反应焓变的影响,则下列说法中正确的是( )
2NO(g),△H=+180.50 kJ·mol-1;△S=247.7 J·mol-1·K-1。若该反应在一密闭容器中进行,若不考虑温度对该反应焓变的影响,则下列说法中正确的是( )
A. 能使该反应物中活化分子数和活化分子百分数同时增大的方法只能是使用催化剂
B. 到达平衡状态时,v(N2)=2v(NO)
C. 在1000℃时,此反应能自发进行
D. 一定温度下,该反应达到平衡状态后,增加N2的浓度,化学反应平衡常数变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.1 mol·L-1的盐酸中逐滴加入0.1 mol·L-1的氨水,溶液pH的变化与加入氨水的体积关系如图所示。下列叙述正确的是

A. V=20mL
B. 在点①所示溶液中:c(Cl-)=c(H+)
C. 在点②所示溶液中:c(H+)=c(NH3·H2O)+c(OH-)
D. 在点②、③之间可能存在:c(NH4+)>c(Cl-)=c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N-苯基苯甲酰胺 广泛应用于药物,可由苯甲酸
广泛应用于药物,可由苯甲酸 与苯胺
与苯胺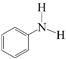 反应制得,由于原料活性低,可采用硅胶催化、微波加热的方式,微波直接作用于分子,促进活性部位断裂,可降低反应温度。取得粗产品后经过洗涤-重结晶等,最终得到精制的成品。
反应制得,由于原料活性低,可采用硅胶催化、微波加热的方式,微波直接作用于分子,促进活性部位断裂,可降低反应温度。取得粗产品后经过洗涤-重结晶等,最终得到精制的成品。
已知:
溶剂 物质 | 水 | 乙醇 | 乙醚 |
苯甲酸 | 微溶 | 易溶 | 易溶 |
苯胺 | 易溶 | 易溶 | 易溶 |
N-苯基苯甲酰胺 | 不溶 | 易溶于热乙醇,冷却后易于结晶析出 | 微溶 |
下列说法不正确的是
A. 反应时断键位置为C-O键和N-H键
B. 洗涤粗产品用水比用乙醚效果更好
C. 产物可选用乙醇作为溶剂进行重结晶提纯
D. 硅胶吸水,能使反应进行更完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属冶炼的说法正确的是
A. 工业上常用电解NaCl水溶液可制取金属钠
B. 工业上常用电解MgO熔融可制取金属镁
C. 工业上常用CO高温条件下还原Fe2O3可制取Fe
D. 工业上常用金属钠和TiCl4溶液反应制取金属Ti
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在水溶液中1mol Cl-、ClOx- (x=1,2,3,4)的能量(kJ)相对大小如图所示。下列有关说法正确的是
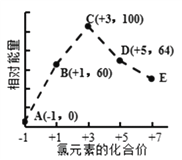
A. 这些离子中结合H+能力最强的是E
B. A、B、C、D、E五种微粒中C最稳定
C. C→B+D,反应物的总键能大于生成物的总键能
D. B→A+D反应的热化学方程式为:3ClO—(aq) == ClO3—(aq) + 2Cl—(aq) △H = -116kJmol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com