
【题目】一定条件下,在水溶液中1mol Cl-、ClOx- (x=1,2,3,4)的能量(kJ)相对大小如图所示。下列有关说法正确的是
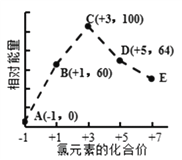
A. 这些离子中结合H+能力最强的是E
B. A、B、C、D、E五种微粒中C最稳定
C. C→B+D,反应物的总键能大于生成物的总键能
D. B→A+D反应的热化学方程式为:3ClO—(aq) == ClO3—(aq) + 2Cl—(aq) △H = -116kJmol-1
【答案】D
【解析】分析:从图示变化看,A为Cl-,B为ClO-,C为ClO2-,D为ClO3—,E为ClO4-;能量越低越稳定,-1价的Cl-能量最低,也最稳定,+3价的ClO2-能量最高,最不稳定;酸性越弱的酸,越容易结合氢离子;根据盖斯定律进行计算C→B+D,2ClO2-→ClO-+ClO3-,△H =64+60-100×2=-76 kJmol-1,该反应放热,据此判断;根据盖斯定律进行计算B→A+D:3ClO—(aq) == ClO3—(aq) + 2Cl—(aq),△H =64-3×60-0=-116kJmol-1,据此判断。
详解:A.酸性越弱的酸,结合氢离子能力越强,次氯酸为最弱的酸,所以ClO-结合氢离子能力最强,A错误;B.根据图像可知氯元素的价态越低,能量最低,最稳定,所以A、B、C、D、E五种微粒中A最稳定,B错误;C.2ClO2-→ClO-+ClO3-,根据盖斯定律可知:△H =64+60-100×2=-76 kJmol-1,该反应为放热反应,反应物的总键能小于生成物的总键能,C错误;3ClO—(aq) == ClO3—(aq) + 2Cl—(aq),根据盖斯定律可知:△H =64-3×60--0=-116kJmol-1,D正确;正确选项D。


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】将铁、铝的混合物加入到足量氢氧化钠溶液中,充分反应后过滤,再将过滤得到的固体加入到足量的硫酸铜溶液中,充分反应后过滤得到的固体质量正好与原固体质量相等,则原固体中铝的质量分数为( )
A. 14.3% B. 12.5% C. 87.5% D. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 [实验化学]
3,4亚甲二氧基苯甲酸是一种用途广泛的有机合成中间体,微溶于水,实验室可用KMnO4氧化3,4亚甲二氧基苯甲醛制备,其反应方程式为

实验步骤如下:
步骤1:向反应瓶中加入3,4亚甲二氧基苯甲醛和水,快速搅拌,于70~80 ℃滴加KMnO4溶液。反应结束后,加入KOH溶液至碱性。
步骤2:趁热过滤,洗涤滤饼,合并滤液和洗涤液。
步骤3:对合并后的溶液进行处理。
步骤4:抽滤,洗涤,干燥,得3,4亚甲二氧基苯甲酸固体。
(1)步骤1中,反应结束后,若观察到反应液呈紫红色,需向溶液中滴加NaHSO3溶液,![]() 转化为_____________(填化学式);加入KOH溶液至碱性的目的是____________________________。
转化为_____________(填化学式);加入KOH溶液至碱性的目的是____________________________。
(2)步骤2中,趁热过滤除去的物质是__________________(填化学式)。
(3)步骤3中,处理合并后溶液的实验操作为__________________。
(4)步骤4中,抽滤所用的装置包括_______________、吸滤瓶、安全瓶和抽气泵。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mlbmol·L-1的CH3COOH溶液中滴加等体积的0.01mol·L-1的NaOH溶液,充分反应后溶液中c(CH3COO-)=c(Na+),下列说法不正确的是
A. b>0.01
B. 混合后溶液呈中性
C. CH3COOH的电离常数Ka=![]()
D. 向CH3COOH溶液中滴加NaOH溶液的过程中,水的电离程度逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一学生设计入图所示装置进行NaHCO3的分解,并证实产物中有CO2产生。

(1)试管中发生的化学反应方程式是____________________________。
(2)指出该学生设计的装置图的错误之处,并改正(文字说明即可)(至少2处)____________。
(3)烧杯中发生反应的离子方程式是_______________________________。
(4)如果将16.8gNaHCO3加热一段时间,然后将剩余固体溶于水,并加入足量的CaCl2溶液,最终得到白色沉淀5.0g,则NaHCO3分解百分率为______________,加CaCl2后反应的离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃时,Ka(HF)=6.0×10-4,Ksp(MgF2)=5.0×10-11。现向1 L 0.2 mol·L-1 HF溶液中加入 1 L 0.2 mol·L-1 MgCl2溶液。下列说法中正确的是( )
A. 25 ℃时,0.1 mol·L-1 HF溶液中pH=1
B. 0.2 mol·L-1 MgCl2溶液中离子浓度关系为2c(Mg2+)=c(Cl-)>c(H+)=c(OH-)
C. 2HF(aq)+Mg2+(aq)![]() MgF2(s)+2H+(aq),该反应的平衡常数K=1.2×107
MgF2(s)+2H+(aq),该反应的平衡常数K=1.2×107
D. 该反应体系中有MgF2沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示某化学反应过程中,生成物的量与时间的关系,图中a、b、c三条曲线不能反映下列哪种因素对生成物的量的影响( )

A. 不同的温度 B. 不同的pH值
C. 不同的底物浓度 D. 不同的酶浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸氯丙嗪也叫冬眠灵,是第一个抗精神病药,开创了药物治疗精神疾病的历史,某研究小组利用下列途径合成盐酸氯丙嗪。

已知: 
请回答:
(1) B中含有官能团名称为__________________;
(2) 下列说法不正确的是____________;
A. 化合物B可以发生加成反应
B. 化合物D在一定条件下既可与酸反应,又可以与碱反应
C. 合成路线中属于取代反应的为(1) (3) (4) (6)
D. 反应(7)是为了提高氯丙嗪的水溶性
(3) 写出E→F的化学反应方程式________________________________________________。
(4) 该研究小组在实验中发现,苯环上直接用Cl2取代的产率一般不到10%,请你设计合理步骤,利用甲苯为原料,合成化合物C________。(注:苯甲酸的苯环上发生取代反应时,取代主要发生在羧基的间位)
(5) 请写出符合下列条件的所有E的同分异构体________。
a. 分子中含有一个萘环![]() ,且为萘的邻位二取代物(邻位不包括
,且为萘的邻位二取代物(邻位不包括 );
);
b. 分子中有一个五元环;
c. 1H-NMR显示分子中有8种氢。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向[H+]=1×10-6 mol·L-1的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液中[H+]=1×10-3mol·L-1。下列对该溶液的叙述不正确的是( )
A. 该温度高于25 ℃
B. 所得溶液中,由水电离出来的H+的浓度为1×10-11mol·L-1
C. 加入NaHSO4晶体抑制水的电离
D. 该温度下,此NaHSO4溶液与某pH=11的Ba(OH)2溶液混合后溶液呈中性,则消耗的NaHSO4溶液与Ba(OH)2溶液的体积比为100:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com