
【题目】 [实验化学]
3,4亚甲二氧基苯甲酸是一种用途广泛的有机合成中间体,微溶于水,实验室可用KMnO4氧化3,4亚甲二氧基苯甲醛制备,其反应方程式为

实验步骤如下:
步骤1:向反应瓶中加入3,4亚甲二氧基苯甲醛和水,快速搅拌,于70~80 ℃滴加KMnO4溶液。反应结束后,加入KOH溶液至碱性。
步骤2:趁热过滤,洗涤滤饼,合并滤液和洗涤液。
步骤3:对合并后的溶液进行处理。
步骤4:抽滤,洗涤,干燥,得3,4亚甲二氧基苯甲酸固体。
(1)步骤1中,反应结束后,若观察到反应液呈紫红色,需向溶液中滴加NaHSO3溶液,![]() 转化为_____________(填化学式);加入KOH溶液至碱性的目的是____________________________。
转化为_____________(填化学式);加入KOH溶液至碱性的目的是____________________________。
(2)步骤2中,趁热过滤除去的物质是__________________(填化学式)。
(3)步骤3中,处理合并后溶液的实验操作为__________________。
(4)步骤4中,抽滤所用的装置包括_______________、吸滤瓶、安全瓶和抽气泵。
【答案】[实验化学]
(1)SO42 将反应生成的酸转化为可溶性的盐
(2)MnO2
(3)向溶液中滴加盐酸至水层不再产生沉淀
(4)布氏漏斗
【解析】分析:(1)反应结束后,反应液呈紫红色,说明KMnO4过量,KMnO4具有强氧化性将HSO3-氧化成SO42-。根据中和反应原理,加入KOH将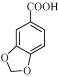 转化为可溶于水的
转化为可溶于水的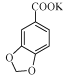 。
。
(2)MnO2难溶于水,步骤2中趁热过滤是减少 的溶解,步骤2中趁热过滤除去的物质是MnO2。
的溶解,步骤2中趁热过滤除去的物质是MnO2。
(3)步骤3中,合并后的滤液中主要成分为 ,为了制得
,为了制得 ,需要将合并后的溶液进行酸化。
,需要将合并后的溶液进行酸化。
(4)回忆抽滤装置即可作答。
详解:(1)反应结束后,反应液呈紫红色,说明KMnO4过量,KMnO4具有强氧化性将HSO3-氧化成SO42-,反应的离子方程式为2MnO4-+3HSO3-=2MnO2↓+3SO42-+H2O+H+。根据中和反应原理,加入KOH将 转化为可溶于水的
转化为可溶于水的 。
。
(2)MnO2难溶于水,步骤2中趁热过滤是减少 的溶解,步骤2中趁热过滤除去的物质是MnO2。
的溶解,步骤2中趁热过滤除去的物质是MnO2。
(3)步骤3中,合并后的滤液中主要成分为 ,为了制得
,为了制得 ,需要将合并后的溶液进行酸化;处理合并后溶液的实验操作为:向溶液中滴加盐酸至水层不再产生沉淀。
,需要将合并后的溶液进行酸化;处理合并后溶液的实验操作为:向溶液中滴加盐酸至水层不再产生沉淀。
(4)抽滤所用的装置包括布氏漏斗、吸滤瓶、安全瓶和抽气泵。


科目:高中化学 来源: 题型:
【题目】在常温下,铁与水并不起反应,但在高温下,铁与水蒸气可发生反应。 应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“铁与水蒸气的反应实验”。

请回答该实验中的问题。
(1)写出该反应的反应方程式:__________________________________;并指明该氧化还原反应的还原剂是____________,氧化剂是______________。
(2)实验前必须对整套装置进行气密性检查,操作方法是_______________________________。
(3)圆底烧瓶中盛装有水,该装置受热后的主要作用是____________________________;烧瓶底部放置了几片碎瓷片,碎瓷片的作用是__________________。
(4)酒精灯和酒精喷灯点燃的顺序是__________________________________,为什么?___________________________________________________________________。
(5)干燥管中盛装的物质是________________________,作用是_______________________。
(6)试管中收集的气体是__________,如果要在A处玻璃管处点燃该气体,则必须对该气体进行____________________,方法是________________________________。这一操作的目的是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N-苯基苯甲酰胺 广泛应用于药物,可由苯甲酸
广泛应用于药物,可由苯甲酸 与苯胺
与苯胺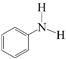 反应制得,由于原料活性低,可采用硅胶催化、微波加热的方式,微波直接作用于分子,促进活性部位断裂,可降低反应温度。取得粗产品后经过洗涤-重结晶等,最终得到精制的成品。
反应制得,由于原料活性低,可采用硅胶催化、微波加热的方式,微波直接作用于分子,促进活性部位断裂,可降低反应温度。取得粗产品后经过洗涤-重结晶等,最终得到精制的成品。
已知:
溶剂 物质 | 水 | 乙醇 | 乙醚 |
苯甲酸 | 微溶 | 易溶 | 易溶 |
苯胺 | 易溶 | 易溶 | 易溶 |
N-苯基苯甲酰胺 | 不溶 | 易溶于热乙醇,冷却后易于结晶析出 | 微溶 |
下列说法不正确的是
A. 反应时断键位置为C-O键和N-H键
B. 洗涤粗产品用水比用乙醚效果更好
C. 产物可选用乙醇作为溶剂进行重结晶提纯
D. 硅胶吸水,能使反应进行更完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属冶炼的说法正确的是
A. 工业上常用电解NaCl水溶液可制取金属钠
B. 工业上常用电解MgO熔融可制取金属镁
C. 工业上常用CO高温条件下还原Fe2O3可制取Fe
D. 工业上常用金属钠和TiCl4溶液反应制取金属Ti
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A可以作水果的催熟剂,D是食醋的主要成分。相关的转化关系如下:

请回答下列问题:
(1)A的结构简式为______________,C的名称是_________________。
(2)反应①的反应类型是______________。
(3)反应③的化学方程式为__________________,该反应类型是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室模拟用工业废弃固体(含有Cu2S、Al2O3、Fe2O3、SiO2等)制取粗铜、绿矾(FeSO4·7H2O)和明矾[KAl(SO4)2·12H2O]的操作流程如下:

(1)试剂X是________________________________________(写化学式)。
(2)配平下列方程式:
______MnO4-+______SO2+______H2O===______Mn2++______SO42-+______H+______________
(3)为了分析产品(绿矾)中铁元素的含量,某同学称取20.0 g样品配成100 mL溶液,移取至锥形瓶中,用1.000×10-1 mol·L-1的KMnO4标准溶液进行滴定(MnO![]() 被还原为Mn2+)。若两者正好反应时消耗KMnO4标准溶液的体积为100.00 mL,则该产品中铁元素的质量分数为___________。(写出解题过程)
被还原为Mn2+)。若两者正好反应时消耗KMnO4标准溶液的体积为100.00 mL,则该产品中铁元素的质量分数为___________。(写出解题过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,a、b是石墨电极,通电一段时间后,b极附近溶液显红色。下列说法正确的是( )

A. X极是电源负极,Y极是电源正极
B. a极的电极反应是2Cl--2e-=Cl2↑
C. 电解过程中CuSO4溶液的pH逐渐增大
D. Pt极上有6.4 g Cu析出时,b极产生2.24 L(标准状况)气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在水溶液中1mol Cl-、ClOx- (x=1,2,3,4)的能量(kJ)相对大小如图所示。下列有关说法正确的是
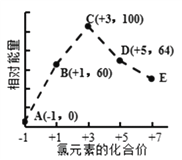
A. 这些离子中结合H+能力最强的是E
B. A、B、C、D、E五种微粒中C最稳定
C. C→B+D,反应物的总键能大于生成物的总键能
D. B→A+D反应的热化学方程式为:3ClO—(aq) == ClO3—(aq) + 2Cl—(aq) △H = -116kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X是一种蓝黑色(有时是粉红色)的固体,是一种由趋磁细菌制造的生物矿。某研究小组按如下流程探究该固体的组成:

请回答:
(1)已知化合物X中只含两种元素,则X中含有的元素是_____。
(2)请写出E反应生成F的化学方程式:_______________。
(3)化合物X与盐酸反应,反应后得到浅绿色溶液,同时生成一种浅黄色不溶物和一种臭鸡蛋气味气体,请写出该反应的离子方程式:_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com