
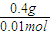 =40g/mol,所以A的摩尔质量为40g/mol-16g/mol=24g/mol,又A原子核内质子数目与中子数目相等,则质子数为12,即A为Mg元素;B元素原子核外第三层电子数目比第一层多1个,最外层电子数为3,则B为Al;C-比A元素的离子多1个电子层,则C的质子数为18-1=17,即C为Cl元素;D元素的原子核外第二层比第一层多2个电子,则第二层电子数为4,即D为C元素,并利用元素及其单质、化合物的性质来解答.
=40g/mol,所以A的摩尔质量为40g/mol-16g/mol=24g/mol,又A原子核内质子数目与中子数目相等,则质子数为12,即A为Mg元素;B元素原子核外第三层电子数目比第一层多1个,最外层电子数为3,则B为Al;C-比A元素的离子多1个电子层,则C的质子数为18-1=17,即C为Cl元素;D元素的原子核外第二层比第一层多2个电子,则第二层电子数为4,即D为C元素,并利用元素及其单质、化合物的性质来解答.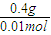 =40g/mol,所以A的摩尔质量为40g/mol-16g/mol=24g/mol,又A原子核内质子数目与中子数目相等,则质子数为12,即A为Mg元素;B元素原子核外第三层电子数目比第一层多1个,最外层电子数为3,则B为Al;C-比A元素的离子多1个电子层,则C的质子数为18-1=17,即C为Cl元素;D元素的原子核外第二层比第一层多2个电子,则第二层电子数为4,即D为C元素,
=40g/mol,所以A的摩尔质量为40g/mol-16g/mol=24g/mol,又A原子核内质子数目与中子数目相等,则质子数为12,即A为Mg元素;B元素原子核外第三层电子数目比第一层多1个,最外层电子数为3,则B为Al;C-比A元素的离子多1个电子层,则C的质子数为18-1=17,即C为Cl元素;D元素的原子核外第二层比第一层多2个电子,则第二层电子数为4,即D为C元素,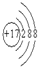 ,C元素位于元素周期表中第二周期、ⅣA,故答案为:
,C元素位于元素周期表中第二周期、ⅣA,故答案为: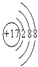 ;第二周期、ⅣA;
;第二周期、ⅣA;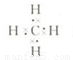 ,空间结构为正四面体型,甲烷与氯气发生取代反应,发生一氯取代、二氯取代、三氯取代、四氯取代都生成HCl,则等物质的量的甲烷与氯气混合,在一定条件下充分反应后,生成物中物质的量最大的是HCl,故答案为:
,空间结构为正四面体型,甲烷与氯气发生取代反应,发生一氯取代、二氯取代、三氯取代、四氯取代都生成HCl,则等物质的量的甲烷与氯气混合,在一定条件下充分反应后,生成物中物质的量最大的是HCl,故答案为: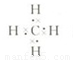 ;正四面体;HCl;
;正四面体;HCl; Mg+Cl2↑,故答案为:MgCl2(熔融)
Mg+Cl2↑,故答案为:MgCl2(熔融) Mg+Cl2↑;
Mg+Cl2↑; Al2O3+3Fe,该反应属于放热反应,由方程式可知反应中有0.25mol氧化铁参加反应,则消耗Al的物质的量为0.25mol×2=0.5mol,其质量为0.5mol×27g/mol=13.5g,由Al元素的化合价变化可知反应中转移电子的个数为0.5mol×(3-0)×NA=9.03×1023,
Al2O3+3Fe,该反应属于放热反应,由方程式可知反应中有0.25mol氧化铁参加反应,则消耗Al的物质的量为0.25mol×2=0.5mol,其质量为0.5mol×27g/mol=13.5g,由Al元素的化合价变化可知反应中转移电子的个数为0.5mol×(3-0)×NA=9.03×1023, Al2O3+3Fe;放热;13.5g;9.03×1023;
Al2O3+3Fe;放热;13.5g;9.03×1023; 

科目:高中化学 来源: 题型:




查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解






 2ZX3(g),在一定温度下的定容容器中,下列事实不能说明该反应已经达到平衡的标志的是
2ZX3(g),在一定温度下的定容容器中,下列事实不能说明该反应已经达到平衡的标志的是查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解




| ||
| ||
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com