
【题目】下列关于反应与能量的说法正确的是
A.Zn(s)+CuSO4(aq)![]() ZnSO4(aq)+Cu(s) ΔH=216 kJ/mol:E反应物<E生成物
ZnSO4(aq)+Cu(s) ΔH=216 kJ/mol:E反应物<E生成物
B.CaCO3(s)![]() CaO(s)+CO2(g) ΔH=+178.2 kJ/mol:E反应物<E生成物
CaO(s)+CO2(g) ΔH=+178.2 kJ/mol:E反应物<E生成物
C.HCl(g)![]()
![]() H2(g)+
H2(g)+![]() Cl2(g) ΔH=+92.3 kJ/mol:1 mol HCl在密闭容器中分解后放出92.3 kJ的热量
Cl2(g) ΔH=+92.3 kJ/mol:1 mol HCl在密闭容器中分解后放出92.3 kJ的热量
D.H+(aq)+OH(aq)![]() H2O(l) ΔH=57.3 kJ/mol:含1 mol NaOH的烧碱溶液与含0.5 mol H2SO4的浓H2SO4混合后放出57.3 kJ的热量
H2O(l) ΔH=57.3 kJ/mol:含1 mol NaOH的烧碱溶液与含0.5 mol H2SO4的浓H2SO4混合后放出57.3 kJ的热量
【答案】B
【解析】
A. 反应物的总能量大于生成物的总能量的反应为放热反应;
B. 反应物的总能量小于生成物的总能量的反应为吸热反应
C. 该反应为吸热反应;
D. 强酸强碱的稀溶液发生中和反应生成1mol水时放出的热量为中和热。
A. 该反应为放热反应,反应物的总能量大于生成物的总能量,即E反应物>E生成物,A项错误;
B. 该反应为吸热反应,反应物的总能量小于生成物的总能量,即E反应物<E生成物,B项正确;
C. 该反应为吸热反应,因此1 mol HCl在密闭容器中分解后吸收92.3 kJ的热量,C项错误;
D. 浓硫酸反应时放出更多的热量,因此含1 mol NaOH的烧碱溶液与0.5 mol H2SO4的浓H2SO4混合后放出的热量大于57.3 kJ,D项错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】下图表示有关物质(均由短周期元素形成)之间的转化关系,其中A为常见的金属单质,B为非金属单质(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化合物。(反应条件图中已省略。)
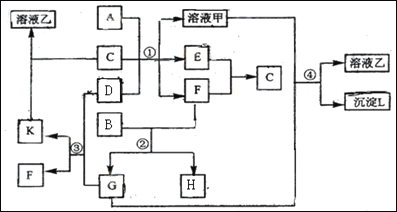
(1)A、B、C、D代表的物质分别为_______、________、_______、_______(填化学式);
(2)反应①中的C、D均过量,该反应的化学方程式是_______;
(3)反应②中,若B与F物质的量之比为4∶3,G、H分别是_______、________(填化学式);
(4)反应③产物中K的化学式为______________________________;
(5)反应④的离子方程式为________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼![]() 是重要的化工原料,广泛地应用于医药、农药、染料等。其在工业上常利用尿素氧化法制备,反应原理为
是重要的化工原料,广泛地应用于医药、农药、染料等。其在工业上常利用尿素氧化法制备,反应原理为![]() 。某同学在实验室模仿工业制备方法制备
。某同学在实验室模仿工业制备方法制备![]() 。回答下列问题:
。回答下列问题:
(1)![]() 溶液的制备,装置如图所示。
溶液的制备,装置如图所示。

①实验室利用二氧化锰和浓盐酸制备氯气的离子方程式为_________________。
②实验需要用到![]() 的NaOH溶液,配制该溶液所需玻璃仪器除量筒外还有_____。
的NaOH溶液,配制该溶液所需玻璃仪器除量筒外还有_____。
③锥形瓶中发生反应的化学方程式为___________________________。
④因后续实验需要,需利用中和滴定原理测定反应后锥形瓶中混合溶液中NaOH的浓度。利用所提供试剂,设计实验方案:____________________________所提供的试剂有:![]() 溶液、
溶液、![]() 溶液、
溶液、![]() 的盐酸、酚酞试液。
的盐酸、酚酞试液。
(2)水合肼的制备,装置如图所示。

实验步骤:控制反应温度![]() 加热装置已省略
加热装置已省略![]() ,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应后,持续加热蒸馏三颈烧瓶内的溶液,收集
,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应后,持续加热蒸馏三颈烧瓶内的溶液,收集![]() 馏分于锥形瓶中。已知
馏分于锥形瓶中。已知![]() 。分液漏斗中的溶液是_________
。分液漏斗中的溶液是_________![]() 填“
填“![]() 溶液”或“NaOH和NaClO混合溶液”
溶液”或“NaOH和NaClO混合溶液”![]() ,选择的理由是___________。
,选择的理由是___________。
(3)馏分中水合肼含量的测定。
称取馏分![]() ,加入适量的
,加入适量的![]() 固体
固体![]() 滴定过程中,控制溶液的pH保持在
滴定过程中,控制溶液的pH保持在![]() 左右
左右![]() ,加水配成
,加水配成![]() 溶液,移出
溶液,移出![]() ,用
,用![]() 的
的![]() 溶液滴定。实验测得消耗
溶液滴定。实验测得消耗![]() 溶液的平均值为
溶液的平均值为![]() ,馏分中水合肼
,馏分中水合肼![]() 的质量分数为_____。
的质量分数为_____。![]() 已知:
已知:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应aA(g)≒bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
A.平衡向正反应方向移动了B.物质A的转化率减少了
C.物质B的质量分数减小了D.a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)![]() N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
A | B | C | D |
|
|
|
|
升高温度, | 0~3s内,反应速率为: | t1时仅加入催化剂, | 达平衡时,仅改变x,则x为c(O2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为比较Fe3+和Cu2+对H2O2分解的催化效果,甲乙两组同学分别设计了如图一、图二所示的实验。
(1)可通过观察图一的现象:_______________,而定性比较得出结论。有同学提出将CuSO4改为CuCl2更为合理,其理由是_____________,你认为还可以作何改进?____________________。
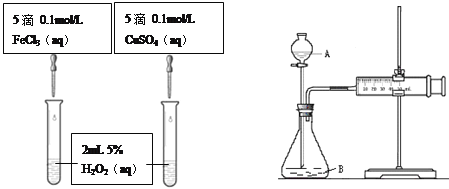
图一 图二
(2)检查图二装置气密性的方法是_______________________。图二所示实验中需测量的数据是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10 mL浓度为0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
A. 水的电离程度始终增大
B. ![]() 先增大再减小
先增大再减小
C. c(CH3COOH)与c(CH3COO-)之和始终保持不变
D. 当加入氨水的体积为10 mL时,c (NH4+)=c(CH3COO-)
【答案】D
【解析】试题分析:A、CH3COOH属于弱酸,抑制水的电离,加入NH3·H2O,消耗CH3COOH,水的电离程度增大,但氨水过量后,对水电离抑制,故错误;B、当向CH3COOH溶液中滴加相同浓度的NH3·H2O,开始时溶液为CH3COOH和CH3COONH4的混合物,由CH3COONH4的水解常数Kh=[c(H+)×c(NH3·H2O)]/c(NH4+),随着氨水的加入,c(H+)逐渐减小,Kh不变,因此c(NH4+)/c(NH3·H2O)变小,当氨水至溶液显碱性时,氨水的电离常数Kb=[c(OH-)×c(NH4+)]/c(NH3·H2O),随着氨水的加入,c(OH-)逐渐增大,Kb不变,c(NH4+)/c(NH3·H2O)变小,因此此比值始终变小;C、根据物料守恒,n(CH3COOH)+n(CH3COO-)=0.001mol,由于溶液体积逐渐增大,因此c(CH3COOH)和c(CH3COO-)之和逐渐减小,故错误;D、当加入氨水的体积为10mL,醋酸和NH3·H2O物质的量相等,由于二者电离常数相等,因此溶液显中性,c(H+)=c(OH-),根据电荷守恒,c(NH4+)=c(CH3COO-),故正确。
考点:考查电离平衡常数、水解平衡常数、离子浓度大小比较等知识。
【题型】单选题
【结束】
13
【题目】常温下,下列有关离子浓度及pH大小的比较,正确的是( )
A. NH4+浓度相同的下列溶液:①(NH4)2Fe(SO4)2 ②(NH4)2CO3 ③(NH4)2SO4,溶液浓度由大到小的顺序是:③>②>①
B. 由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,其离子浓度不可能是:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
C. pH=13的Ba(OH)2溶液与pH=1的HCl溶液等体积混合后,混合溶液的pH>7
D. pH=12的Ba(OH)2溶液与pH=14的NaOH溶液等体积混合,混合溶液的pH范围是13<pH<14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列用来表示物质变化的化学用语错误的是( )。
A.氢氧燃料电池在碱性介质中的正极反应式:O2 + 2H2O + 4e-= 4 OH-
B.用惰性电极电解饱和氯化钠溶液的离子方程式为:2C1一+ 2H2O = H2↑+ Cl2↑+ 2OH-
C.钢铁发生电化学腐蚀的负极反应式:Fe - 3e- = Fe3+
D.粗铜精炼时,与电源负极相连的是纯铜,电极反应式为:Cu2+ + 2e-= Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种微生物电池可进行多种污水净化和海水淡化的综合处理,该电池装置的示意图如图所示,其中污
水中的有机物用C6H10O5表示,海水用食盐水代替。下列说法正确的是

A. b膜为阴离子交换膜
B. 处理后的含NO3-污水的pH降低
C. 负极反应式为C6H10O5+7H2O+24e-==6CO2↑+24H+
D. 导线中流过lmol电子,理论上有1molCl-通过a膜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com